ОТ РЕДАКЦИИ
«Центр Фармацевтической Аналитики» получил статус-награду «Лидер отрасли 2023» и соответствующий сертификат от Всероссийского бизнес-рейтинга.
МЕРОПРИЯТИЯ
Конгресс «Разработка и регистрация лекарственных средств» пройдет в Москве в гибридном формате 27 и 28 февраля 2024 г. Программа конгресса состоит из нескольких секций, где мы поговорим про фармацевтическую разработку оригинальных и воспроизведенных ЛС, доклинические и клинические исследования, проводимые в соответствии с требованиями Решений ЕЭК. Также будут представлены секции, рассматривающие вопросы технологий получения лекарственных средств, трансфера технологий и регуляторные вопросы.
Москва, 07 сентября 2023 г. состоялся семинар «Разработка и регистрация лекарственных средств в ЕАЭС и РФ – текущие достижения и стратегический взгляд в будущее».
22 сентября состоялся конгресс «Химико-фармацевтические и биологические препараты: фармацевтическая и клиническая разработка согласно правилам ЕАЭС» в здании конгресс-центра Сеченовского Университета в Москве. Организаторами конференции традиционно выступают ООО «Центр фармацевтической аналитики» и журнал «Разработка и регистрация лекарственных средств». Мероприятие посетило 149 человек.
Главными темами деловой программы стали подходы к регулированию обращения лекарственных средств, отраслевое образование, межведомственное взаимодействие, научно обоснованный подход при производстве лекарственных средств, лицензирование производства, особенности обеспечения соответствия требованиям правил GMP, фармацевтический инжиниринг, типичные несоответствия при фарминспекциях.
Представители профильных министерств и эксперты отрасли обсудили готовность российской промышленности к обеспечению потребностей системы здравоохранения.
ПОИСК И РАЗРАБОТКА НОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Введение. Применение радиофармацевтических препаратов для таргетной радионуклидной терапии (РНТ), эффективность которых была установлена в ходе клинических исследований, является безопасным и эффективным методом терапии различных патологических состояний, в том числе онкологических заболеваний. Основной особенностью терапевтических радиофармацевтических лекарственных препаратов (РФЛП) является использование β–- и α-излучающих радионуклидов (РН) в готовой лекарственной форме (ГЛФ). Среди радионуклидов, используемых для радионуклидной терапии, лютеций-177 на сегодняшний день является одним из наиболее популярных в клинической практике, что обусловлено его химическими и ядерно-физическими характеристиками. Список разрабатываемых РФЛП на основе лютеция-177 постоянно расширяется, а препараты Lutathera® ([177Lu]Lu-DOTA-TATE) и Pluvicto™ ([177Lu]Lu-PSMA-617) уже одобрены для применения в клинической практике ряда стран.
Текст. Ввиду высокой активности РН в одной дозе терапевтического РФЛП (до 8 ГБк в монодозе для 177Lu) ионизирующее излучение используемых РН приводит к снижению качества РФЛП из-за радиолитической деградации векторной молекулы. Это приводит к снижению специфичного накопления радиоактивности в очагах патологии, снижению терапевтического эффекта и потенциально увеличивает риск радиотоксичности для нецелевых органов и тканей. Степень и интенсивность радиолитической деградации векторной молекулы, а следовательно и срок хранения ГЛФ РФЛП, зависят от многих факторов, среди которых объемная активность радионуклида в препарате, его период полураспада и энергия испускаемых частиц являются наиболее весомыми. Для подавления эффектов радиолиза в составы готовых лекарственных форм вводят различные вспомогательные вещества, проявляющие антиоксидантные (радиопротекторные) свойства. Среди используемых и исследуемых веществ наиболее популярными являются гентизиновая и аскорбиновая кислоты, а также этанол. В данной работе на примерах препаратов лютеция-177 рассмотрены преимущества и недостатки различных антиоксидантов и их комбинаций, используемых в составе терапевтических РФЛП.
Заключение. Подбор оптимального состава лекарственной формы является актуальной задачей, так как позволит обеспечить высокое качество РФЛП как на момент приготовления, так и в течение срока хранения и поставки конечному потребителю, что существенно облегчит применение и централизованную поставку терапевтических РФЛП. Показана необходимость создания унифицированного подхода к подбору антиоксидантов на стадии фармацевтической разработки радиофармпрепаратов. Для достижения этой цели весьма перспективным и доказавшим свою эффективность представляется подход, объединяющий исследования кинетики радикальных реакций с исследованиями радиационно-химических выходов продуктов радиолиза в одинаковых или максимально близких условиях с последующей проверкой стабильности ГЛФ РФЛП. Напротив, эмпирический подход, подразумевающий подбор радиопротекторов на основе прямого исследования их влияния на сохранение уровня радиохимической чистоты, является неоптимальным ввиду высокой рыночной стоимости как радионуклидов, так и нерадиоактивных прекурсоров.
Введение. Клеточные технологии широко распространены в различных областях биологии, биотехнологии и сельского хозяйства. Аралия сердцевидная (Aralia cordata Thunb.) – многолетнее травянистое растение, внесенное в Красную книгу Российской Федерации. Препараты на основе сырья аралии обладают ценными видами фармакологической активности и широко используются в восточной медицине. Серьезным препятствием для возобновления естественных популяций является наличие у семян растения периода морфофизиологического покоя. Ограниченность природного ареала и выраженная биологическая активность делает аралию сердцевидную перспективным объектом для введения в культуру in vitro.
Цель. Целью работы являлось получение жизнеспособной каллусной культуры аралии сердцевидной, изучение условий индукции соматического эмбриогенеза.
Материалы и методы. В качестве первичного экспланта были использованы части листа растения, культивируемого в Ботаническом институте им. В. Л. Комарова РАН. Части листа стерилизовали в 2%-м растворе бензалкония хлорида в течение 5 минут, индукцию каллусогенеза осуществляли на среде Мурасиге – Скуга. С целью длительного пассивирования были изучены среды различного состава. Индукцию соматического эмбриогенеза проводили на средах с высоким содержанием ауксинов. Спиртовые извлечения из интактного растения и каллусных культур анализировали методом ВЭТСХ с использованием системы HPTLC PRO SYSTEM (CAMAG AG, Швейцария).
Результаты и обсуждение. Спустя две недели культивирования на поверхности эксплантов наблюдали образования первичного каллуса. Наиболее подходящей средой для длительного поддержания культур была признана среда Линсмайера – Скуга с уменьшенным количеством сахарозы (20 г/л). Были получены эмбриоидные структуры аралии сердцевидной. Качественный анализ извлечений показал, что каллусные культуры накапливают тритерпеновые гликозиды, их состав приближен к таковому у интактного растения.
Заключение. Был получен жизнеспособный штамм каллусной культуры аралии сердцевидной, установлена питательная среда для длительного культивирования культур. Были получены соматические эмбриоиды. Предварительное фитохимическое исследование показало, что состав химических компонентов каллусов приближен к составу интактного растения.
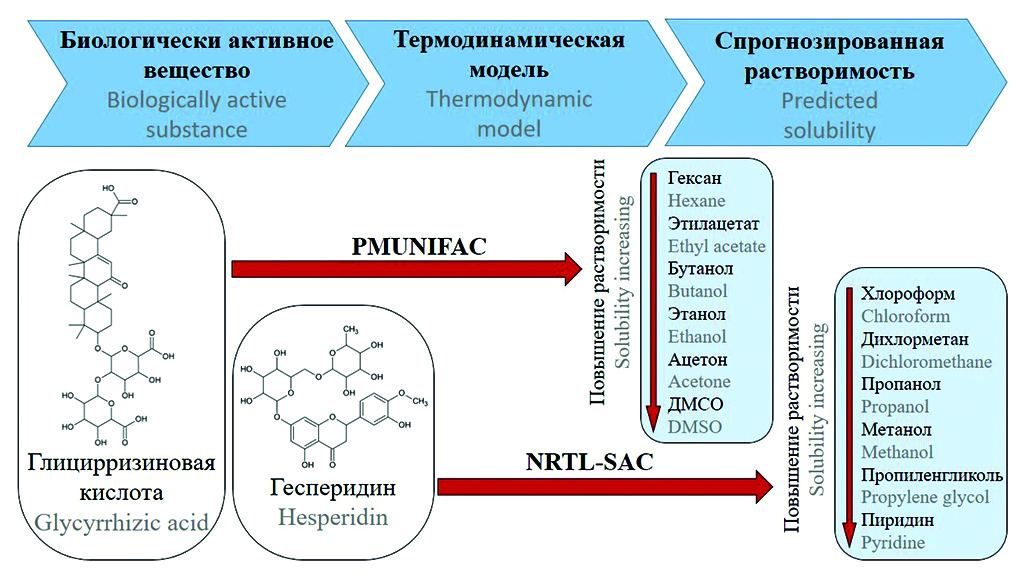
Введение. Выбор растворителей для процессов извлечения биологически активных веществ из природного сырья, процессов очистки природных и синтезированных субстанций методами экстракции, кристаллизации и растворения является важной проблемой современной фармацевтической промышленности, поскольку для определения оптимального растворителя или смеси растворителей необходимо выполнить большое количество экспериментов. Чтобы снизить затраты на разработку и оптимизацию стадий извлечения и очистки веществ, предложено использовать термодинамические модели на этапе предварительной оценки растворимости. В статье исследуется вопрос прогнозирования растворимости фармацевтических веществ на примере технологии выделения гесперидина и глицирризиновой кислоты из растительного сырья.
Цель. Теоретическое определение растворяющей способности различных растворителей по отношению к гесперидину и глицирризиновой кислоте.
Материалы и методы. Для прогнозирования растворимости использованы термодинамические модели PMUNIFAC и NRTL-SAC. Расчет растворимости по модели NRTL-SAC выполнен с помощью программного обеспечения «Aspen Properties V14», а по модели PMUNIFAC – с помощью «PTC Mathcad Prime V6». Для оценки результатов, полученных с использованием термодинамических моделей, проводили ряд экспериментов, объектом для которых служила кожура апельсина (высушенные флаведо и альбедо, степень измельчения 0,2–0,5 мм, влажность 8 %). Количественное содержание гесперидина определяли методом прямой спектрофотометрии при длине волны 290 нм. Статистическую обработку данных проводили с использованием программного обеспечения Minitab v20 (Minitab Inc., США), различия считали статистически значимыми при р < 0,05.
Результаты и их обсуждение. На основе термодинамических моделей выполнен прогноз растворимости гесперидина и глицирризиновой кислоты. Показано, что оценку растворимости возможно производить как при наличии данных о растворимости по модели NRTL-SAC, так и при их полном отсутствии по модели PMUNIFAC. Соответствие теоретически рассчитанных данных экспериментальным подтверждает правильность расчетов термодинамических моделей. Результаты расчетов оценены, и рекомендованы растворители, которые могут быть использованы в технологии выделения гесперидина и глицирризиновой кислоты для стадий обезжиривания, экстракции и кристаллизации с антирастворителем.
Заключение. С помощью термодинамических моделей NRTL-SAC и PMUNIFAC определена растворяющая способность различных растворителей по отношению к гесперидину и глицирризиновой кислоте. По результатам расчетов построен список растворителей, ранжированный по растворимости в них изучаемых веществ. Полученный список может использоваться при разработке промышленной технологии извлечения и очистки гесперидина и глицирризиновой кислоты. Показано, что модели NRTL-SAC и PMUNIFAC имеют хорошие перспективы для количественного прогнозирования растворимости активных веществ.
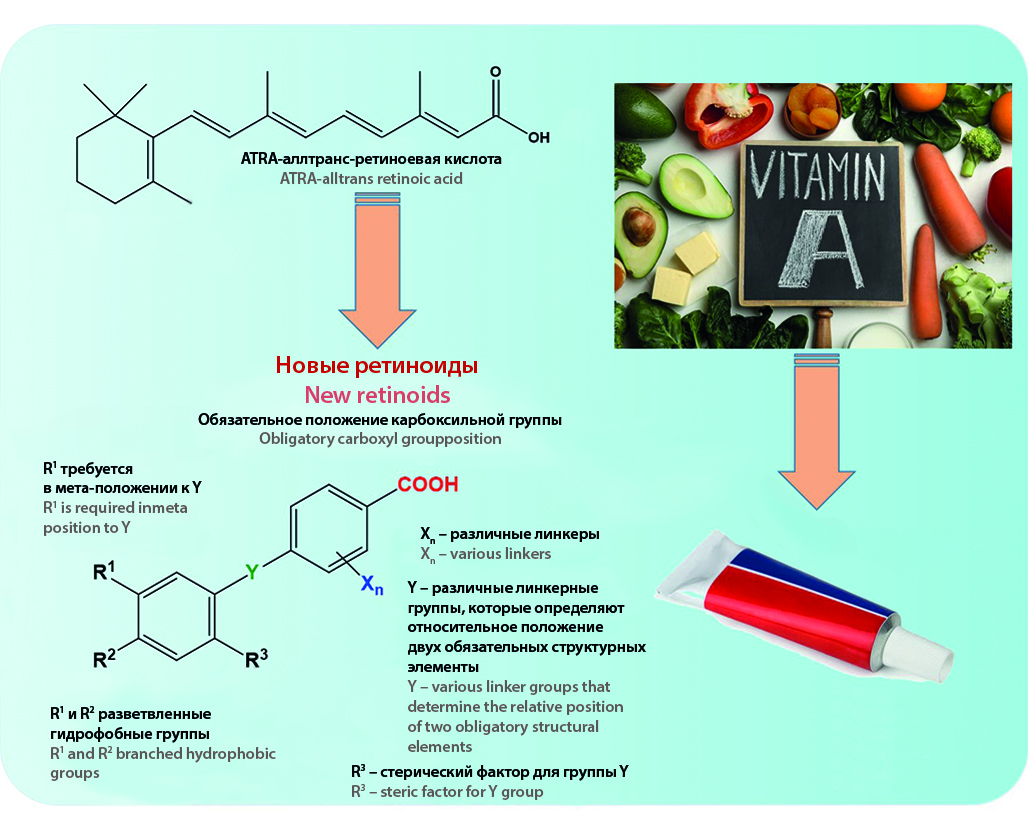
Введение. Ретиноиды представляют собой группу эндогенных и синтетических веществ, регулирующих множество важных биологических процессов нормального развития. Синтез и изучение биологической активности новых ретиноидов являются перспективной областью химической биологии.
Текст. Геномные функции ретиноидов опосредованы их ядерными рецепторами RAR(α, β, γ) и RXR(α, β, γ), которые регулируют транскрипцию генов с привлечением корепрессоров и коактиваторов. Ретиноиды также обладают негеномными функциями, ацилируя белки и другие биомолекулы. Передовыми областями исследований биологической активности ретиноидов являются регенеративная медицина и биология стволовых клеток. Эндогенные и синтетические ретиноиды применяются для лечения кожных патологий и онкологических заболеваний. Есть данные о возможности использования их в терапии заболеваний легких. Разработка ретиноидов, обладающих высокой селективностью в отношении отдельных рецепторов и тканей, может открыть новые подходы к лечению и профилактике таких нейродегенеративных заболеваний, как болезнь Альцгеймера, болезнь Паркинсона и другие. Ретиноиды необходимы для функционирования иммунной системы и являются очень мощными иммуномодуляторами. Кроме того, ретиноиды обладают потенциалом для терапии различных пролиферативных заболеваний.
Заключение. Многолетние исследования фармакологической активности ретиноевой кислоты и ее структурных аналогов направлены на изучение и установление точных механизмов их действия, а также степени их участия в патогенезе различных заболеваний. Получение синтетических ретиноидов преследует цель дизайна соединений с высокой избирательностью по отношению к определенным рецепторам, что позволило бы исключить мультитаргетное действие естественных регуляторных молекул и обусловленные этим побочные эффекты. Лишенные тератогенных и других побочных эффектов синтетические ретиноиды могут найти применение в качестве терапевтических средств для лечения дефектного метаболизма, различных злокачественных новообразований, а также заболеваний почек, легких и ЦНС. Кроме того, разработка пролекарств на основе ретиноидов с контролируемым высвобождением активных молекул также является перспективным направлением в этой области медицинской химии.
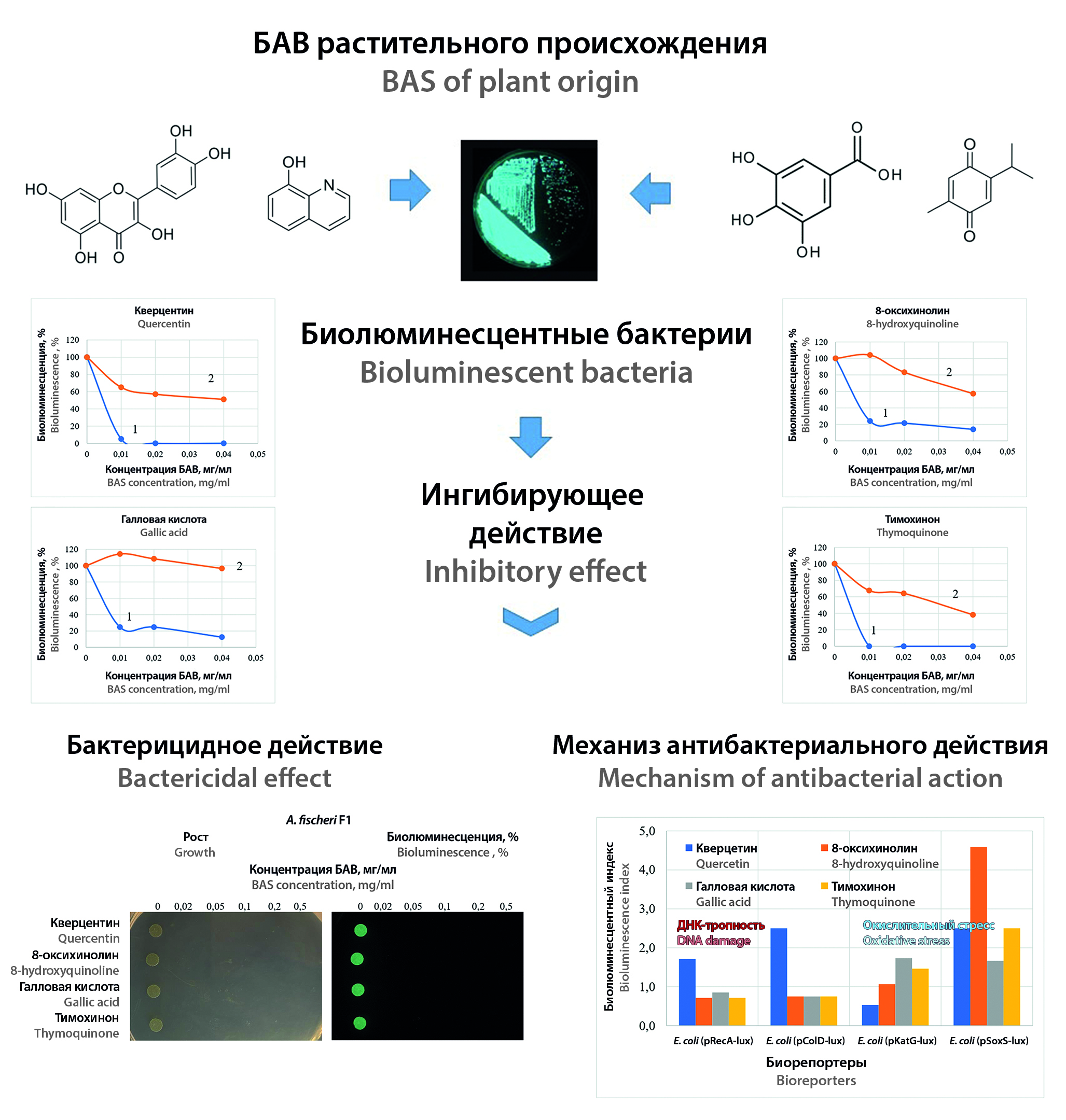
Введение. В настоящее время поиск новых антибактериальных веществ является актуальной задачей из-за растущей устойчивости патогенов к существующим антибиотикам. Одним из ключевых направлений в этой области является расширение научных исследований лекарственного сырья растительного происхождения в качестве новых источников терапевтических средств. В данной работе изучается возможность применения для этих целей высокочувствительных бактериальных тест-обьектов, обладающих биолюминесценцией, которые позволяют быстро выявить неспецифическую антимикробную активность и могут быть адаптированы к технологиям высокопроизводительного фармацевтического скрининга.
Цель. Изучение применимости биолюминесцентных бактерий для анализа антибактериальной активности биологически активных веществ (БАВ) растительного происхождения.
Материалы и методы. В работе использовали биологически активные вещества кверцетин, 8-гидроксихинолин, галловую кислоту и тимохинон, которые часто встречаются в лекарственном растительном сырье и с которыми связывают его антибактериальные свойства. В качестве тест-обьектов использовали бактерии с конститутивной биолюминесценцией Aliivibrio fischeri F1 и Escherichia coli (pXen7), а также рекомбинантные биорепортерные штаммы с индуцибельным свечением: E. coli (pRecA-lux), E. coli (pColD-lux), реагирующие на повреждение нуклеиновых кислот; E. coli (pKatG-lux), E. coli (pSoxS-lux), чувствительные к окислительному стрессу.
Результаты и обсуждение. Установлено, что неспецифическая антимикробная активность исследуемых БАВ проявляется в ингибировании бактериальной биолюминесценции тест-штаммов с конститутивным свечением. Отмечено, что морские тест-бактерии A. fischeri F1 обладают значительно большей чувствительностью к действию БАВ растительного происхождения по сравнению с рекомбинантным штаммом E. coli (pXen7). Показано, что их ингибирующее действие начинается при концентрациях 2 мкг/мл, а бактерицидность наступает при концентрациях от 20 мкг/мл. Приводится сравнение полученных результатов с данными по МИК и МБК грамположительных и грамотрицательных патогенов. Изучение индукции биолюминесценции рекомбинантных биорепортерных штаммов показало, что антибактериальное действие исследуемых БАВ сопровождается окислительным стрессом. Также кверцетин вызывал активацию свечения E. coli (pRecA-lux) и E. coli (pColD-lux), что может свидетельствовать о его участии в повреждении нуклеиновых кислот. Анализ факторов индукции биорепортерных штаммов указывает на то, что выявленные механизмы антибактериальной активности не являются основными, а могут иметь второстепенный характер.
Заключение. Показано, что интенсивность свечения природных и рекомбинантных биолюминесцентных бактерий может быть показателем антибактериальной активности БАВ природного происхождения. Установлена высокая чувствительность бактерий A. fischeri F1 к действию таких веществ, как кверцетин, 8-гидроксихинолин, галловая кислота и тимохинон. Учитывая, что биолюминесцентный анализ является количественным инструментальным методом, он может быть легко адаптирован для проведения высокопроизводительного фармацевтического скрининга.
ФАРМАЦЕВТИЧЕСКАЯ ТЕХНОЛОГИЯ
Введение. Совершенствование технологий выделения и очистки биологически активных веществ из растительного сырья – важная задача для фармацевтической, пищевой и косметической отраслей промышленности. Разработка технологий зачастую требует внесения изменений в конструкцию существующего оборудования. При модернизации оборудования для реализации новых технологий возможна доработка его конфигурации, позволяющая с минимальными затратами значительно повышать выход активных веществ. Для повышения эффективности процесса выделения гесперидина из растительного сырья нами предложен ряд технологических решений. В частности, предложено использовать перемешивающие устройства с конфигурацией импеллеров, разработанных на основе методов вычислительной гидродинамики, а при применении экстрактора Сокслета – обогреваемую экстракционную камеру, полученную путем добавления внешней змеевиковой рубашки, позволяющей регулировать температуру внутри экстракционной камеры для ускорения процессов диффузии и массообмена, а растворитель и экстрагент выбирать на основе термодинамических моделей расчетным способом.
Цель. Совершенствование технологии выделения и очистки гесперидина из растительного сырья с использованием модернизированного оборудования.
Материалы и методы. Моделирование распределения потоков в экстракционных аппаратах осуществляли с помощью методов вычислительной гидродинамики. Для оценки результатов, полученных на основе моделирования, проводили ряд экспериментов, объектом для которых служила кожура апельсина (высушенные флаведо и альбедо, степень измельчения – 0,1–0,2 мм, влажность – 3,5 %). Количественное содержание комплекса флавоноидов в пересчете на гесперидин определяли методом прямой спектрофотометрии при длине волны 290 нм, количественное содержание гесперидина определяли гравиметрически. Статистическую обработку данных проводили с использованием программного обеспечения Minitab v21 (Minitab Inc., США), различия считали статистически значимыми при р < 0,05.
Результаты и обсуждения. На основе методов вычислительной гидродинамики для интенсификации процессов перемешивания и растворения на стадиях предварительного обезжиривания сырья и экстрагирования спроектирован шестилопастный импеллер, позволяющий ускорить процессы за счет создания осевых и радиальных потоков движения жидкости в емкостном аппарате и поддержания сырья во взвешенном состоянии в объеме жидкости при малых скоростях перемешивания и низком потреблении электроэнергии. Оснащение экстракционной камеры змеевиковой рубашкой позволило значительно повысить растворимость активного вещества и извлекать больше целевого компонента за один экстракционный цикл. Разработана технология выделения и очистки гесперидина, определены и оптимизированы параметры проведения процессов.
Заключение. В результате исследования показано, что возможно интенсифицировать процессы экстракции и растворения активных веществ путем подбора перемешивающих устройств методом вычислительной гидродинамики. Для выделения плохо растворимых соединений из плотного сырья (корни, кора и пр.) предложена модификация аппарата Сокслета с обогреваемой экстракционной камерой. Модернизация типовых технологических установок позволила получить субстанцию гесперидина с выходом до 95 % и чистотой до 90 % при однократной перекристаллизации.
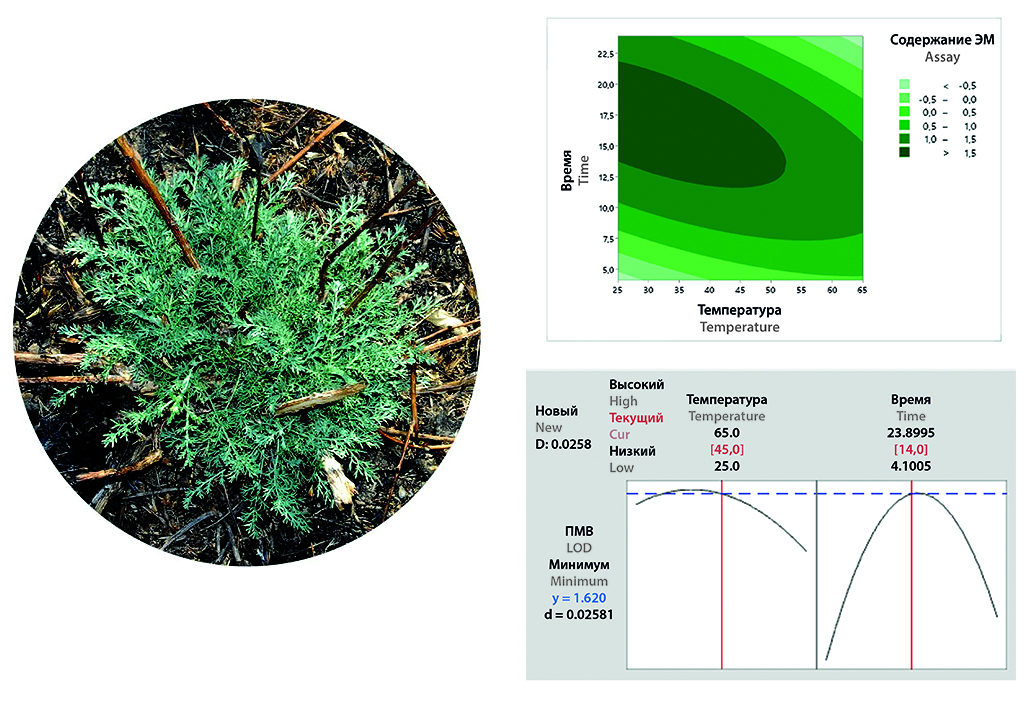
Введение. Выбор оптимального способа сушки ЛРС является важным аспектом получения растительного сырья фармакопейного качества. На площадке фармацевтического предприятия ТОО «Fitoleum» (г. Есик, Казахстан) проведена разработка технологии получения растительной фармацевтической субстанции из травы полыни осенней (Artemisia serotina Bunge), в рамках которой изучены различные способы сушки с применением ИК-излучения, конвективной сушки и теневой сушки в естественных условиях. Параллельно с экспериментальным подходом реализован способ моделирования условий сушки. Разработка технологии получения растительных фармацевтических субстанций реализуется с применением концепции «Quality by Design», одним из принципов которой является моделирование экспериментов (Design of experiments, DoE). Преимущество моделирования при изучении процессов заключается в том, что данная методика позволяет одновременно анализировать несколько входных параметров и их влияние на показатели качества, при этом значительно сокращая количество экспериментов.
Цель. Выбор оптимального способа сушки травы полыни осенней для дальнейшего получения растительного лекарственного препарата или РФС.
Материалы и методы. В процессе эксперимента было использовано следующее оборудование: ручной комбайн для сбора растений, поддоны или стеллажи с сетчатым дном, инфракрасные подложки, конвективный сушильный шкаф, стеллажи с поддонами под навесом в естественных условиях, траворезка, вибросита. Также исследование проведено в соответствии с принципами концепции «Quality by Design» с применением программы Minitab Statistical Software 21, с использованием статистического инструмента – моделирование экспериментов (Design of experiments, DoE).
Результаты и обсуждение. Результаты исследований различных методов сушки показали, что наиболее оптимальной является сушка ИК-излучением, которая позволяет сохранить содержание ЭМ (основной группы БАВ) на оптимальном уровне – около 1,7 % при влажности сырья не более 13 %. Данные, полученные при моделировании эксперимента в программе Minitab, были сопоставимы с результатами классической схемы эксперимента. Установлен оптимальный метод и технологические параметры сушки травы полыни осенней: применение ИК-излучения, температура – 35–45 °C и время сушки – 14–17 ч. Получены сопоставимые данные по исследуемым технологическим параметрам трех последовательно произведенных серий, и подтверждена валидность технологического процесса сушки травы полыни осенней.
Заключение. Проведен сравнительный анализ методов сушки ЛРС травы полыни осенней (Artemisia serotina Bunge): ИК-излучения, конвективной и теневой сушки в естественных условиях. Установлено, что максимальное содержание ЭМ (как основной группы БАВ) в сырье наблюдается при использовании сушки методом ИК-излучения при температуре 35–45 °C в течение 14–17 ч. При этом остаточная влажность ЛРС составляет не более 13 %, что соответствует фармакопейным требованиям. Проведенные исследования прогнозирования оптимальных параметров сушки при помощи программы Minitab Statistical Software 21 показали сопоставимость с результатами эксперимента. На основании полученных результатов предложен оптимальный метод сушки травы полыни осенней для применения в производстве и получения ЛРС фармакопейного качества.
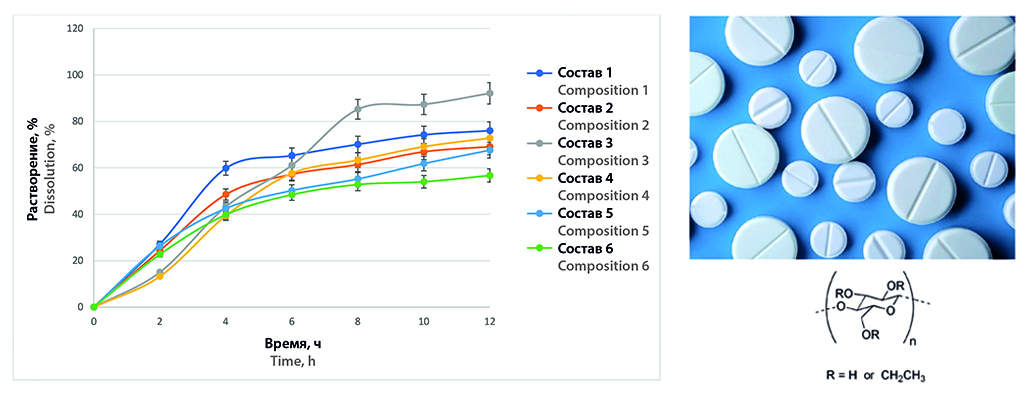
Введение. Технология влажного гранулирования представляет собой процесс направленного укрупнения частиц сыпучих материалов для придания удовлетворительных свойств таблеточным массам и, как следствие, достижения удовлетворительных характеристик целевых таблеток. Кроме того, в результате применения технологии влажного гранулирования при условии использования специальных вспомогательных веществ становится возможным управлять скоростью и кинетикой высвобождения активных фармацевтических субстанций из таблеток для достижения необходимого терапевтического эффекта.
Цель. Изучение влияния матрицеобразующих компонентов, входящих в состав смесей для гранулирования, на скорость высвобождения 4,4’-(пропандиамидо)дибензоата натрия из таблеток.
Материалы и методы. Объектами исследования являлась оригинальная субстанция 4,4’-(пропандиамидо)дибензоат натрия, а также ряд вспомогательных веществ, к числу которых относились полимеры, применяемые для лекарственных форм с пролонгированным высвобождением, опудривающий компонент – стеарилфумарат натрия, а также порообразователи – ПВП и МКЦ. Ключевые параметры таблеток и кинетика растворения были изучены в соответствии с требованиями Государственной фармакопеи (ГФ) РФ XIV изд. и Фармакопеи ЕАЭС.
Результаты и обсуждение. Для всех таблеток удалось достичь пролонгированного высвобождения, однако более 90 % вещества через 12 часов высвобождали таблетки, содержащие этилцеллюлозу в качестве матрицеобразующего полимера. Высвобождение АФС из таблеток данного состава являлось наиболее равномерным и было приближено к кинетике нулевого порядка.
Заключение. Проведено изучение влияния матрицеобразующих компонентов, входящих в состав смесей для гранулирования, на скорость высвобождения 4,4’-(пропандиамидо)дибензоата натрия из таблеток. Наиболее равномерно и полно высвобождается АФС из таблеток, в которых матрицеобразующим полимером является этилцеллюлоза в количестве 27,7 %.
Введение. Всестороннее изучение молекулы активной фармацевтической субстанции (АФС) является одним из определяющих критериев фармацевтической разработки в соответствии с концепцией Quality by Design (QbD) и основными положениями ICH Q8. Пространственное расположение атомов в молекуле нередко оказывает значительное влияние на физико-химические и технологические свойства АФС, а следовательно, и на способ получения готовой лекарственной формы (ГЛФ) из нее.
Цель. Изучение некоторых свойств веществ, геометрических изомеров молекулы, представляющей собой производное диэтиламиноэтанола (ДЭАЭ), а также сравнение выбранных технологий получения ГЛФ.
Материалы и методы. Объектами исследования являлись два вещества, пространственные изомеры молекулы, производного ДЭАЭ, обладающего нейропротекторным, антиастеническим и антиоксидантным действием. Изучение свойств АФС и полученных таблеток было проведено в соответствии с требованиями Государственной фармакопеи Российской Федерации (ГФ РФ) XIV изд., Фармакопеи Евразийского экономического союза, а также Европейской фармакопеи 9.0 изд. В качестве вспомогательных веществ использованы вещества, обладающие не истекшим на момент исследования сроком годности, а также разрешенные для медицинского применения.
Результаты и обсуждение. Геометрическая конфигурация производного ДЭАЭ оказывает влияние на свойства АФС, что влияет на этапы фармацевтической разработки, в особенности на разработку технологии и состава ГЛФ. При использовании цис-ДЭАЭ значительно упрощается технологический процесс и улучшается качество получаемого препарата, и, как следствие, может быть достигнута лучшая стабильность и увеличены сроки хранения ГЛФ.
Заключение. В ходе исследования были изучены некоторые свойства АФС цис-ДЭАЭ и проведено их сравнение с аналогичными свойствами транс-ДЭАЭ. Проведено сравнение технологий получения таблеток на основе двух указанных конфигураций молекулы производного ДЭАЭ. Было установлено, что изомеры обладают различными технологическими свойствами, а также существенно отличаются по влагосорбционной способности. Данное свойство определяет подход к получению таблеток. Технология производства таблеток на основе цис-ДЭАЭ представляется более простой, а ГЛФ на ее основе – более стабильной.
Введение. В настоящее время среди населения распространена проблема заболеваний печени, в особенности неалкогольной жировой болезни печени, а также лекарственных поражений печени. В связи с этим существует необходимость поиска новых решений в разработке препаратов гепатотропной терапии. В клинической практике нередко используются одновременно несколько гепатопротективных средств в виде отдельных препаратов или комбинаций. Комбинированное применение субстанций в одной готовой лекарственной форме (ГЛФ) может обеспечивать как усиление того или иного фармакологического эффекта, так и расширение спектра гепатотропного действия. В состав комбинированных гепатопротекторов часто вводят компоненты растительного происхождения. Плоды расторопши пятнистой содержат не менее 2,4 % суммы флаволигнанов в пересчете на силибин, что обуславливает гепатопротекторный эффект лекарственных препаратов на их основе и объясняет перспективность использования данного растительного сырья в терапии заболеваний печени.
Цель. Разработка технологии получения сухого экстракта расторопши пятнистой плодов, обогащенного силибином.
Материалы и методы. Объектами исследования служили расторопши пятнистой плоды (Silybum marianum (L.) Gaertn.) от двух производителей, заготовленные в июне 2022 года. Показатели качества готового продукта, сухого экстракта расторопши пятнистой плодов, определяли по методикам, описанным в Государственной фармакопее (ГФ) РФ XIV изд. Статистическую обработку результатов исследований проводили в соответствии с ГФ РФ XIV, том I, с. 289, ОФС.1.1.0013.15 «Статистическая обработка результатов химического эксперимента».
Результаты и обсуждение. Предложен эффективный метод экстрагирования лекарственного растительного сырья (ЛРС), позволяющий получить наибольший выход биологически активных веществ (БАВ). Предложен способ очистки спиртоводного извлечения после экстракции. Разработана технология получения сухого экстракта расторопши пятнистой плодов. Проведена стандартизация полученного сухого экстракта.
Заключение. В ходе исследования разработана технология получения сухого экстракта расторопши пятнистой плодов. Определены показатели качества фитосубстанции, сухого экстракта расторопши пятнистой плодов, обогащенного силибином.
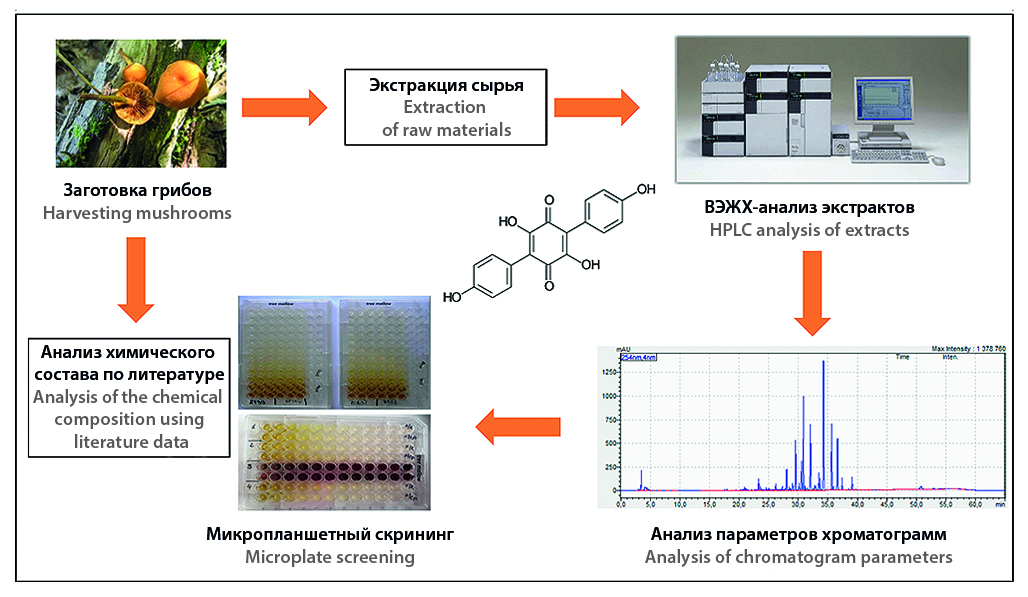
Введение. Возникновение новых штаммов микроорганизмов, обладающих множественной лекарственной устойчивостью (МЛУ) в отношении применяемых противомикробных лекарственных препаратов, является одной из актуальных проблем современной медицины. Для предотвращения наращивания смертей, связанных с МЛУ, процесс поиска новых антибиотиков и их внедрение в медицинскую практику должны идти непрерывно. Инфекционные заболевания также сопровождаются повреждением клеток и развитием свободнорадикальных процессов окисления, соответственно, поиск новых антиоксидантов – важная задача. С учетом мощного биосинтетического потенциала базидиомицетов данная группа грибов имеет все перспективы стать новым источником биологически активных веществ в целом, а также антибиотиков и антиоксидантов в частности. Шляпочные грибы, представленные преимущественно базидиомицетами, насчитывают около 14 000 видов и являются доступным источником сырья для поиска перспективных антимикробных соединений и антиоксидантов.
Цель. Изучение антиоксидантной и противомикробной активности суммарных экстрактов, полученных из шляпочных грибов, в отношении Escherichia coli, Staphylococcus aureus и Candida albicans и оценка пригодности шляпочных грибов для использования в качестве природного источника веществ с противомикробной и антиоксидантной активностью.
Материалы и методы. Противогрибковую и антибактериальную активность экстрактов определяли микрометодом двукратных серийных разведений в жидкой питательной среде в 96-луночных планшетах в двух повторах. Изучение данного вида биологической активности осуществляли в отношении референтных (типовых) штаммов Staphylococcus aureus ATCC 6538-P, Escherichia coli ATCC 25922, Candida albicans NCTC 885-653. Для исследований антиоксидантной активности с помощью DPPH использовали спиртовые извлечения из плодовых тел грибов, полученные методом мацерации 96%-м этанолом при соотношении сырья и экстрагента 1 к 8 в течение суток, водный раствор аскорбиновой кислоты (витамина С) и этанольный раствор тролокса.
Результаты и обсуждение. В отношении представителя грамположительной флоры S. aureus исследуемые экстракты шляпочных грибов проявили низкую активность, в среднем порядка 2500 или 5000 мкг/мл. В отношении представителя грамотрицательной флоры E. coli 8 % исследуемых экстрактов шляпочных грибов проявили среднюю активность порядка 1250 мкг/мл. Наибольшее количество экстрактов шляпочных грибов – 19 % от всех исследуемых видов проявили активность в отношении дрожжевого микромицета C. albicans. Наиболее высокая активность против C. albicans наблюдалась у экстрактов грибов Cantharellula umbonata с МИК 625 мкг/мл, Cortinarius olivaceofuscus с МИК 625 мкг/мл и Hypomyces chrysospermus с МИК 312 мкг/мл. В ходе скрининга антиоксидантной активности исследуемые извлечения разделили на три группы: с высокой (более 50 % ППР), средней (от 15 до 50 % ППР) и низкой (менее 15 %) антиоксидантной активностью. Было показано, что сумма фенольных соединений значимо коррелирует с уровнем антиоксидантной активности во всех трех группах, но в группах со средней и низкой антиоксидантной активностью присутствуют также другие, нефенольные группы веществ, вносящие значимый вклад в общую антиоксидантную активность.
Заключение. Шляпочные грибы представляют собой перспективный источник биологически активных веществ с противогрибковой и антиоксидантной активностью.
Введение. «Эбастин», антигистаминный препарат второго поколения, выпускается в форме орально диспергируемых таблеток и таблеток, покрытых пленочной оболочкой. Субстанция эбастина характеризуется высокой биодоступностью, но низкой растворимостью в воде и средах желудочно-кишечного тракта. Для решения проблемы низкой растворимости эбастина предложена технология создания твердых дисперсий на основе полимерных носителей методом экструзии горячего расплава.
Цель. Разработка состава и технологии получения экструдата для создания аморфной твердой дисперсной системы эбастина с целью ускорения процесса высвобождения и повышения биодоступности.
Материалы и методы. Эбастин микронизированный (АО «Активный Компонент», Россия); эбастин кристаллический (Arevipharma GmbH, Германия); VIVAPHARM® PVP/VA 64 (JRS Pharma GMbH & Co. KG, Германия). Экструдаты получали на двухшнековом лабораторном экструдере с сонаправленным вращением шнеков HAAKE™ miniCTW (Thermo Fisher Scientific, Германия). Образцы исследовали методами дифференциальной сканирующей калориметрии, синхронного термического анализа, порошковой рентгеновской дифракции и ИК-фурье-спектроскопии. Количественное содержание действующего вещества определяли методом спектрофотометрии, а содержание родственных примесей в аморфной твердой дисперсии эбастина определяли методом ВЭЖХ.
Результаты и обсуждение. Разработана технология получения аморфной твердой дисперсии эбастина методом экструзии горячего расплава, значительно улучшены фармакокинетические свойства активного вещества, оптимизирован процесс получения твердой дисперсии, содержащей 20 % эбастина, с целью уменьшения содержания количества примесей в экструдате.
Заключение. Максимальная концентрация эбастина для аморфной твердой дисперсии надлежащего качества на основе PVP/VA64 составила 20 %. Получение твердой дисперсии методом экструзии горячего расплава с содержанием эбастина в PVP/VA64 выше 30 % невозможно, так как расплав не стеклуется.
Введение. После появления эмпаглифлозина на фармацевтическом рынке отмечается рост публикаций, посвященных первичной и вторичной фармакодинамике препарата, увеличивается перечень потенциальных показаний к применению данного ингибитора натрий-глюкозного котранспортера. Гипотезы о фармакологических эффектах и механизмах их реализации проверяются как в масштабных клинических исследованиях, так и в экспериментах на животных.
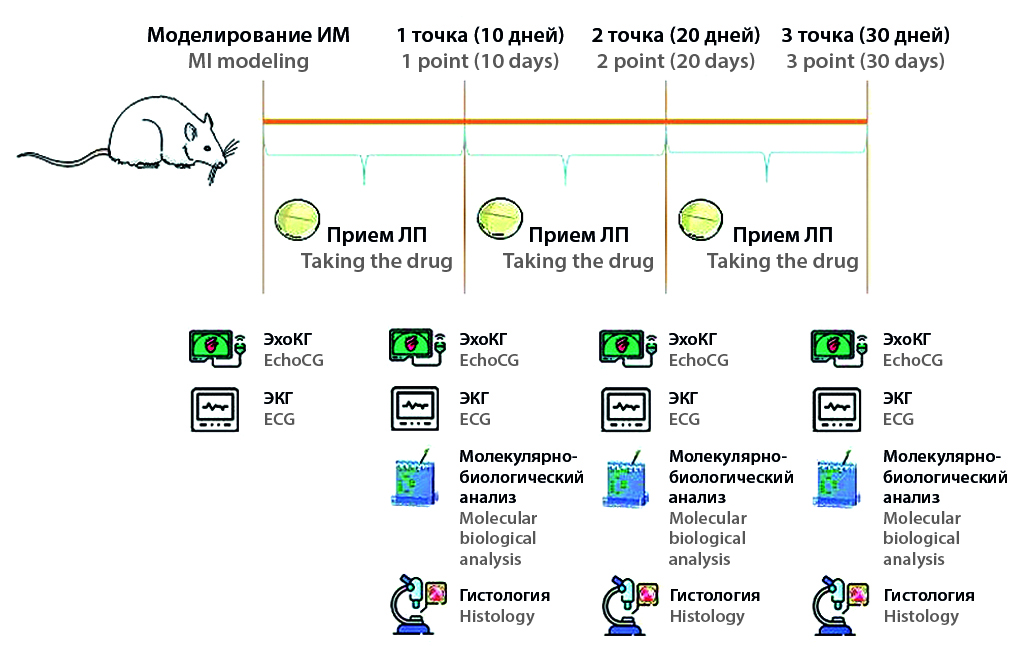
Цель. Целью данной работы являлись исследования эффективности эмпаглифлозина с использованием эхокардиографических, гистологических и молекулярно-биологических анализов в трех наиболее значимых точках динамического перехода от острого инфаркта миокарда к постинфарктной хронической сердечной недостаточности на лабораторных крысах-самцах.
Материалы и методы. Эксперимент выполнялся на 60 аутбредных крысах-самцах. Инфаркт миокарда моделировали у наркотизированных животных путем перманентной перевязки левой коронарной артерии. Основываясь на данных эхокардиографического (ЭхоКГ) исследования, животных рандомизировали на две группы: контрольный инфаркт – группа патологии без лечения, получавшая плацебо, – и группа терапии с патологией, получавшая эмпаглифлозин в дозе 1 мг/кг per os внутрижелудочно ежедневно с первого дня эксперимента. На 10, 20 и 30-й день после операции животным проводили ЭхоКГ-исследование, производилась эвтаназия части животных по 10 из каждой группы для выполнения гистологического исследования и молекулярного анализа.
Результаты и обсуждение. Использование эмпаглифлозина у животных после моделирования инфаркта миокарда способствовало значимому увеличению работоспособности миокарда на 10, 20 и 30-й день, достигая максимума на 20-й день (47,58 ± 1,87 %). Препарат способствует длительному сохранению зоны повреждения сердечной мышцы с ранним образованием зрелой соединительной ткани, а также увеличивает сопротивляемость миокарда к воздействию гипоксии путем роста количества HIF-1.
Заключение. На основании проведенных исследований можно сделать вывод о возможности применения натрий-глюкозного котранспортера 2 типа эмпаглифлозина при формировании постинфарктной хронической сердечной недостаточности в условиях нормогликемии.
Введение. В статье представлены результаты исследования влияния критических параметров микрокапсулирования на свойства микрокапсул, полученных методом диффузии эмульсионного растворителя. Полученные результаты позволили установить удовлетворительные параметры ведения процесса, такие как скорость перемешивания, тип перемешивающего устройства, объем водной фазы, концентрация полимера в масляной фазе, соотношение «лекарственное вещество (ЛВ) : полимер», температурные условия.
Цель. Целью работы стало изучение влияния параметров ведения процесса микрокапсулирования на свойства микрокапсул, полученных методом диффузии эмульсионного растворителя.
Материалы и методы. В качестве модельной субстанции для микрокапсулирования был использован ибупрофен. Полимером-носителем был выбран Eudragit® RS 100. Для оценки формы и характера поверхности микрокапсул использовали микроскоп Levenhuk D80L LCD, определение размеров микрокапсул проводили с помощью лазерного анализатора частиц «Микросайзер 201С» (ООО «ВА Инсталт», Россия).
Результаты и обсуждение. Изучено влияние параметров ведения процесса микрокапсулирования на свойства микрокапсул ибупрофена, полученных методом диффузии эмульсионного растворителя, как модельной субстанции. Установлены параметры технологии, определены зависимости между критическими параметрами микрокапсулирования и свойствами образующихся микрокапсул.
Заключение. В ходе выполнения исследования предложен и обоснован выбор технологических параметров микрокапсулирования методом диффузии эмульсионного растворителя. Полученные экспериментальные данные на примере ибупрофена как модельной субстанции будут положены в основу эксперимента при получении микрокапсул на основе других АФС, растворимых в органических растворителях.
Введение. Персонализированный подбор антигипертензивных комбинаций лекарственных средств (ЛС) и их дозировок является одним из перспективных направлений в области комбинированной терапии артериальной гипертензии (АГ). Для реализации данной концепции может быть использован полипилл в виде твердой желатиновой капсулы, содержащей комбинацию мини-таблеток.
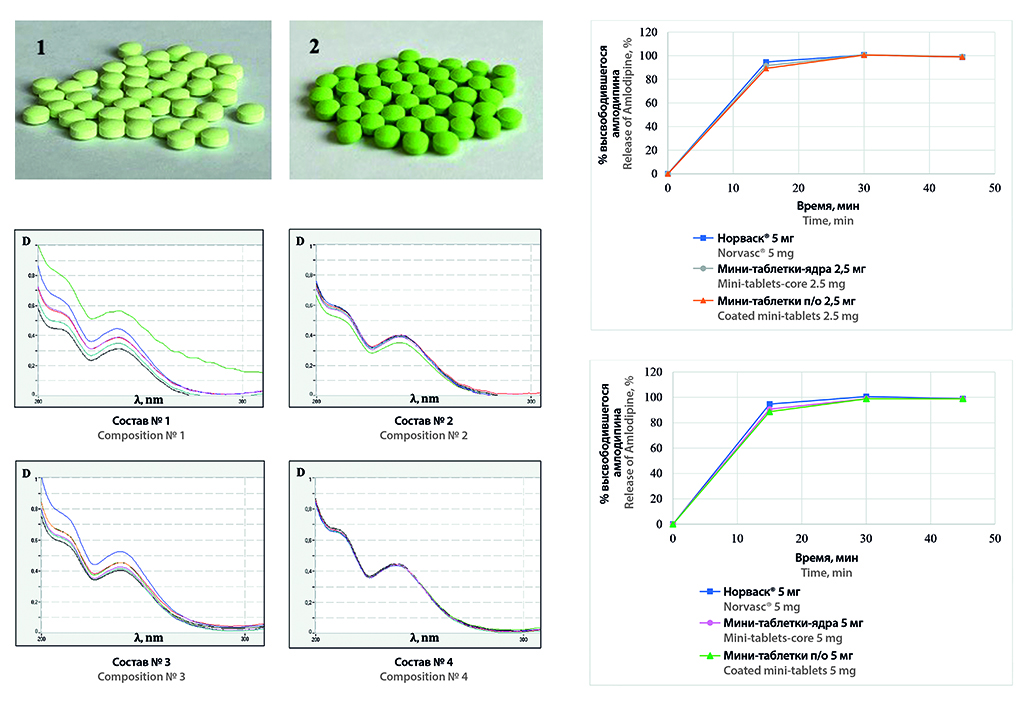
Цель. Разработка состава и технологии мини-таблеток амлодипина с дозировками 2,5 мг и 5 мг, покрытых цветными пленочными оболочками, как компонента полипилла для реализации персонализированной терапии АГ.
Материалы и методы. В исследовании использовали активную фармацевтическую субстанцию (АФС) амлодипина безилата (Glochem Industries Private Ltd., Индия), а также вспомогательные вещества (ВВ), выполняющие функции наполнителей, дезинтегранта, опудривающего компонента, красителя и пленкообразующей композиции. Для оценки профилей высвобождения амлодипина в качестве референтного препарата использовали оригинальный препарат Норваск®, таблетки 5 мг. Смешение проводили в лабораторном смесителе типа «пьяная бочка» DGN-II (Shanghai Unique Machinery Technology Co., Ltd., Китай); мини-таблетки прессовали на лабораторном автоматическом однопуансонном таблеточном прессе DP30A (Beijing Gylongli Sci. & Tech.Co., Ltd., Китай); пленочные покрытия на мини-таблетки-ядра наносили с помощью лабораторной установки BGB-1 (Chongqing Jinggong Pharmaceutical Machinery Co., Ltd., Китай). Оценку технологических свойств АФС и таблеточных смесей, а также контроль качества полученных мини-таблеток осуществляли по методикам Государственной фармакопеи РФ XIV издания.
Результаты и обсуждение. В результате исследования обоснован оптимальный состав ВВ группы наполнителей (лактозы моногидрат, МКЦ и кальция гидрофосфат безводный в соотношении 1 : 1 : 1) для получения мини-таблеток-ядер амлодипина 2,5 мг и 5 мг методом прямого прессования. Для различия дозировок и возможности дальнейшего инкапсулирования мини-таблеток разработана технология покрытия цветными пленочными оболочками мини-таблеток-ядер амлодипина 2,5 мг и 5 мг. Установлена эквивалентность профилей высвобождения амлодипина из разработанных мини-таблеток профилю высвобождения амлодипина из референтного препарата.
Заключение. Разработаны состав и технология мини-таблеток амлодипина 2,5 мг и 5 мг, покрытых пленочной оболочкой, являющихся одним из компонентов полипилла, содержащего оригинальную комбинацию ЛС для персонализированной терапии АГ.
Введение. В настоящее время развитие фармацевтического рынка и жесткая конкуренция требуют от компаний, производящих лекарственные препараты (ЛП), более пристальной и детальной модернизации уже существующих производственных линий. Современной и экономичной технологией производства лекарственных форм является технология прямого прессования. Альтернативным подходом к оптимизации производства смесей, для которых ввиду физико-химических и технологических особенностей неприменимо использование технологии влажной грануляции или невозможно прямое прессование, может стать технология сухой грануляции методом компактирования.
Цель. Целью данной работы является изучение возможности получения таблеток ребамипида с применением технологии прямого прессования и технологии сухой грануляции методом компактирования с уходом от технологии влажной грануляции как от технологически сложного и экономически затратного метода, а также исследование влияния технологии на такие показатели качества, как распадаемость и растворение.
Материалы и методы. В качестве материалов использовался ребамипид (N-(4-хлорбензоил)-3-(2-оксо-1,2-дигидрохинолин-4-ил) аланин) (экспериментальный образец), МКЦ-102 (J. Rettenmaier & Söhne (JRS), Германия), крахмал прежелатинизированный (Colorcon Ltd., Великобритания), коллидон SR (BASF, Германия), кроскармеллоза натрия (J. Rettenmaier & Söhne (JRS), Германия), безводная лимонная кислота (Scharlab S.L., Испания), натрия лаурилсульфат (BASF, Германия), аэросил 200 vv (Evonik Industries AG, Германия), натрия стеарилфумарат (J. Rettenmaier & Söhne (JRS), Германия), кальция стеарат (FACI, Италия), пленочное покрытие Вивакоат® PA-1P-000 (J. Rettenmaier & Söhne (JRS), Германия). В качестве оборудования использовался Y-образный смеситель (ООО «АЗТ ФАРМА К.Б.», Россия), ролл-компактор LGC100 (Beijing Gylongli Automation Tech. Co., Ltd., Китай), роторный таблеточный пресс PG16G (Beijing Gylongli Automation Tech. Co., Ltd., Китай), система для покрытия таблеток оболочкой Labcoat™ M (O'Hara Technologies lnc., Канада), антистатический ионизирующий пистолет Simco Cobra (Simco-Ion, Нидерланды), тестер сыпучести ERWEKA GT (ERWEKA GmbH, Германия), тестер насыпной плотности ERWEKA SVM 122 (ERWEKA GmbH, Германия), вибросито CISA RP 200N (CISA Cedaceria Industrial S.L., Испания), прибор для определения прочности, диаметра и толщины таблеток SOTAX HT 10 (SOTAX AG, Швейцария), тестер растворения DT 626/1000НН (ERWEKA GmbH, Германия), тестер распадаемости ZT321 (ERWEKA GmbH, Германия).
Результаты и обсуждение. В ходе ряда экспериментов методами прямого прессования и компактирования были получены таблетки-ядра, а также таблетки, покрытые пленочной оболочкой (ТППО). В результате изучения полученных таблеток было установлено, что при аналогичных составах таблетки, наработанные методом компактирования, отличаются большим временем распадемости и растворения по сравнению с таблетками, полученными прямым прессованием, что следует учитывать при планировании скорости высвобождения действующего вещества в ходе разработки лекарственных препаратов.
Заключение. В результате экспериментов, описанных в данной работе, было установлено, что существует прямая зависимость между использованием определенной технологии и влиянием ее на такие показатели качества, как распадаемость и растворение таблеток. Также установлено, что технология сухой грануляции позволяет получить более технологичную массу для таблетирования.
Введение. Исследования последних лет показали, что природные биологически активные вещества растений эволюционно более близки организму человека, чем синтетические. Они легко включаются в обменные процессы и практически не имеют побочных эффектов, а многие из них являются предшественниками физиологически активных веществ. Примером ценного лекарственного растительного сырья (ЛРС) являются корни шлемника байкальского (Scutellaria baicalensis), в составе которых присутствуют видоспецифичные флавоноиды – байкалин и скутеллярин, обладающие потенциалом для создания противовирусных ЛС и систем функционального питания с антиоксидантными и адаптогенными свойствами. Для нивелирования существующих недостатков использования интактного растения в фармацевтической практике предложен природосберегающий и эргономичный подход к культивированию клеток шлемника байкальского в контролируемых условиях in vitro. Данная технология позволяет извлекать активные вещества S. baicalensis без нанесения ущерба окружающей среде и способствует сокращению времени наработки необходимого количества растительного материала с повышением эффективности производственных процессов.
Цель. Разработка технологии сухого экстракта на основе биомассы каллусных культур S. baicalensis.
Материалы и методы. Объект исследования – биомасса клеток S. baicalensis, полученная из каллусной культуры. Функциональные характеристики (сыпучесть, коэффициент Хауснера, индекс Карра, фракционный состав, а также пористость и гигроскопичность) биомассы шлемника байкальского и сухого экстракта на ее основе рассчитаны согласно методикам Фармакопеи ЕАЭС. Экстракция растительного материала осуществлялась методом мацерации при нагревании на водяной бане с обратным холодильником. Качественный и количественный анализ БАВ в составе сухого экстракта реализован методами спектрофотометрии и высокоэффективной жидкостной хроматографии. Показатели качества и функциональные характеристики готового продукта оценивались в соответствии с фармакопейными требованиями.
Результаты и обсуждение. Проведена оценка функциональных характеристик биомассы шлемника байкальского, и подтверждена возможность получения сухого экстракта на ее основе. Подобраны параметры процесса извлечения БАВ, установлено присутствие байкалина в экстракте биомассы, и проведена сравнительная оценка профиля агликона в экстракте на основе каллусной культуры и корней шлемника байкальского. Оценены свойства готового продукта на предмет соответствия нормативным требованиям, а также технологические характеристики.
Заключение. Показатели качества сухого экстракта биомассы шлемника байкальского удовлетворяют нормативным требованиям, а технологические характеристики являются пригодными для использования полученного продукта в качестве фитосубстанции для разработки ЛС комбинированного типа и биологически активных добавок.
Введение. Диспергируемые в ротовой полости лекарственные формы являются одним из новых направлений в области системы доставки лекарств. К такому виду лекарственных форм относятся пероральные лиофилизаты, которые получают методом лиофильной сушки предварительно приготовленной смеси, содержащей активный фармацевтический ингредиент (АФИ), наполнитель и другие вспомогательные вещества. Данная лекарственная форма (ЛФ) обеспечивает немедленное высвобождение АФИ в ротовой полости, используя при этом небольшое количество вспомогательных веществ.
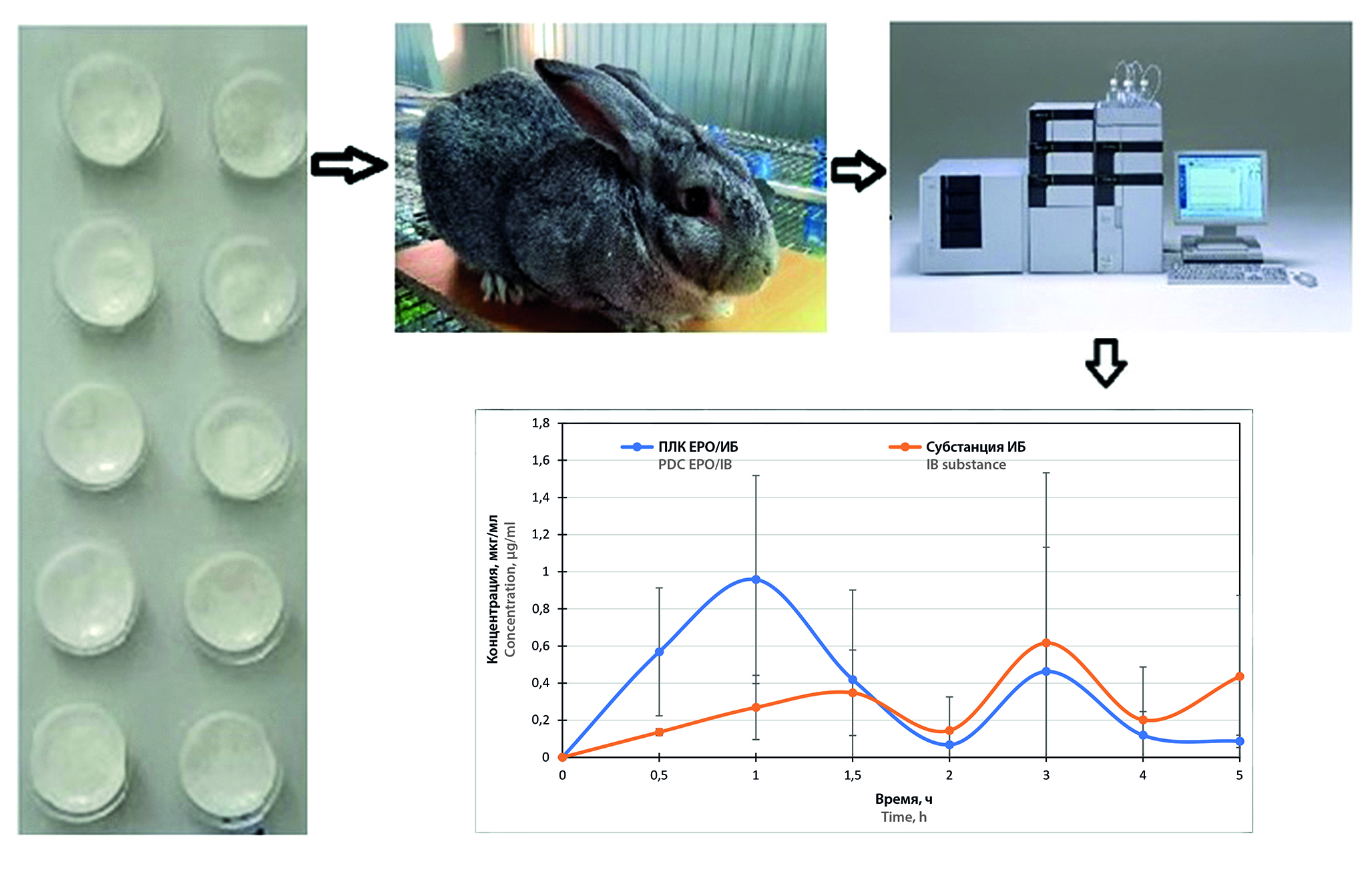
Цель. Фармакокинетическая оценка лиофилизатов с использованием полимер-лекарcтвенного комплекcа Eudragit® E PO / ибупрофен (ПЛК ЕРО-ИБ) и интерполиэлектролитного комплекcа (ИПЭК) Carbopol® Ultrez 10 / Eudragit® E PO (ИПЭК С10/EPO) с метронидазолом (МТЗ).
Материалы и методы. Были получены лиофилизаты следующих составов: 1) 100 мг МТЗ и 50 мг ИПЭК С10/EPO или 2) 100 мг ПЛК ЕРО-ИБ. Готовили дисперсию на основе первого или второго состава в 50%-м сиропе мальтодекстрина, в качестве ПАВ использовали Спан®-80 (1,42 % от общей массы смеси). Полученную дисперсию переносили в блистеры для таблеток, замораживали в лабораторной сушилке FreeZone 1L (Labconco, США) при температуре –49 °С, при давлении 0,350 мбар (время сушки – одни сутки). Для фармакокинетических исследований кроликам породы Советская шиншилла натощак в форме таблетки защечно вводили по одному лиофилизату, содержащему ПЛК ЕРО/ИБ или ИПЭК С10/EPO с МТЗ, в качестве сравнения использовали субстанции ИБ (50 мг) и МТЗ (100 мг), приготовленные в виде водной взвеси. Концентрацию АФИ определяли в сыворотке крови кроликов. Для этого использовали высокоэффективную жидкостную хроматографию (ВЭЖХ), эксперимент проводили на приборе хроматограф LC-20 Prominence (Shimadzu Corporation, Япония), использовался УФ-детектор. Были рассчитаны параметры фармакокинетики, метод – модельно-независимый. Использовалась программа Thermo Kinetika TM (version 5.0, Build 5.00.11, Thermo Fisher Scientific, США).
Результаты и обсуждение. Максимальная концентрация ибупрофена из ПЛК ЕРО/ИБ достигается в течение первого часа после перорального введения. Второй пик на профилях показывает всасывание оставшейся доли АФИ в кровь из желудочно-кишечного тракта (ЖКТ) как в случае ПЛК ЕРО/ИБ, так и в случае ИБ из субстанции. Относительная биодоступность ПЛК ЕРО/ИБ составила Frel = 86,06 %. Лиофилизаты на основе ИПЭК C10/EPO обеспечивают максимальную концентрацию МТЗ через 30 минут (Сmax = 4,659 мкг/мл). Относительная биодоступность составила Frel = 107,6 %.
Заключение. Согласно проведенным исследованиям, максимальная концентрация ИБ и МТЗ достигается в течение первого часа после перорального введения лиофилизатов, содержащих ПЛК ЕРО-ИБ и ИПЭК С10/EPO. Всасывание лекарственных веществ в полости рта происходит благодаря компонентам, входящим в состав диспергируемой ЛФ, а также наличию сополимера ЕРО, ПЛК и ИПЭК, которые способны задерживаться на слизистой оболочке полости рта ввиду выраженных мукоадгезивных свойств. Таким образом, проведенные фармакокинетические исследования ИБ и МТЗ из полученных лиофилизатов доказывают перспективность полученных форм для систем с немедленным высвобождением.
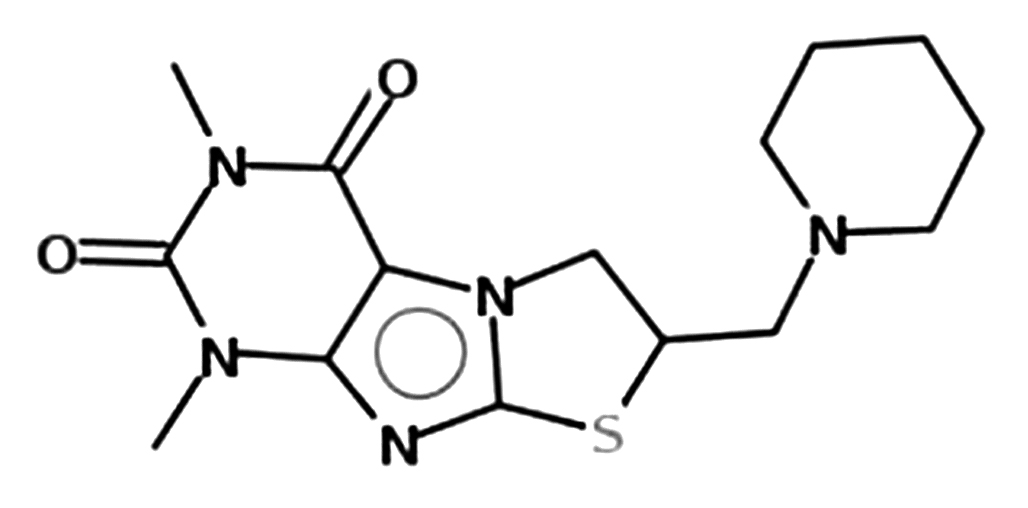
Введение. Депрессия цитохромов Р450 является одной из причин низкой эффективности терапии гепатитов. В ряде исследований подтверждена необходимость применения индукторов монооксигеназной системы гепатоцитов (МСГ) для повышения эффективности лечения хронических гепатитов и цирроза различного генеза. Перспективным веществом-индуктором МСГ является 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантин (ДПДТК), обладающий детоксицирующей и цитопротективной активностью на моделях острой гипобарической гипоксии, ишемии печени, неконъюгированной гипербилирубинемии, токсическом гепатите. Для разработки лекарственной формы 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина необходимо изучить его технологические свойства.
Цель. Разработка таблетированной лекарственной формы 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина методом прямого прессования.
Материалы и методы. Исследовали субстанцию 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина (серия DPDX270216001). Лактозы моногидрат (ЛМ) (200-559-2, ООО «Нефтегазхимкомплект», Россия), микрокристаллическая целлюлоза (МКЦ) (100-32-2, Silverline chemicals Ltd., Индия), крахмал картофельный, гидроксипропилцеллюлоза (ZW180113, Fengchen Group Co., Ltd., Китай), тальк (ООО «Агат-Мед», Россия) и магния стеарат (209-150-3, Ataman Chemicals) были рассмотрены в качестве вспомогательных веществ. Исследование субстанции проводили по показателям: описание, потеря в массе при высушивании, фракционный состав, сыпучесть, насыпная плотность, пористость, прессуемость, сила выталивания таблетки из матрицы. Таблеточные массы оценивали по показателям: сыпучесть, насыпная плотность, прессуемость, сила выталкивания таблетки из матрицы. Анализ получаемых таблеток проводили по параметрам: средняя масса, прочность на раздавливание, распадаемость. Испытания проводились в соответствии с Государственной фармакопеей (ГФ) РФ.
Результаты и обсуждение. Выявлено, что субстанция ДПДТК имеет плохую прессуемость, низкую сыпучесть, малую насыпную массу и высокую пористость. Добавление ЛМ и МКЦ улучшило показатель прессуемости, но увеличило силу выталкивания таблетки из матрицы. Последующее добавление магния стеарата снизило силу выталкивания таблетки из матрицы в 5 раз. Сыпучесть таблеточной массы возросла до 3,5–4,0 г/с, как и время распадаемости таблеток (13–14 мин). Введение 10 % дезинтеграторов улучшило показатель распадаемости (11–12 мин).
Заключение. На основе изученных свойств субстанции разработан оптимизированный состав таблетируемой массы Показана возможность получения лекарственной формы – таблетки ДПДТК методом прямого прессования.
МЕТОДЫ АНАЛИЗА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Введение. Все большую популярность приобретают продукты переработки растительного сырья. Особую ценность представляют продукты эфиромасличного производства – ароматные воды, или гидролаты. Гидролаты широко используются в качестве косметических средств, поскольку содержат ряд биологически активных водорастворимых компонентов эфирного масла, но в отличие от последнего имеют более мягкое воздействие на кожу, что позволяет использовать их в чистом виде.
Цель. Изучить химический состав, антибактериальную и антиоксидантную активность гидролатов.
Материалы и методы. В качестве объектов исследования использовались гидролаты производства АО «АЭМСЗ», полученные из растений Lavandula angusifolia, Hyssоpus officinаlis, Sаlvia officinаlis, Rosmarinus officinalis, Rosa damascеna × Rosa gallica. Анализ состава проводили методами ГЖХ. Антибактериальные свойства гидролатов изучали на морских биолюминесцентных тест-бактериях Aliivibrio fischeri F1 и рекомбинантных бактериях Escherichia coli (pXen7). Изучение антиоксидантного действия проводилось методом Fe3+-индуцированного перекисного окисления липидов суспензии яичных липопротеидов in vitro.
Результаты и обсуждение. Было выявлено, что гидролат шалфея содержит α- и β-туйон, β-кариофиллен, α-терпинеол; гидролат лаванды – камфен, линалоол, линалилацетат, гераниол, геранилацетат; гидролат розмарина – камфен, 1,8-цинеол, β-пинен; гидролат розы – фенилэтанол, гераниол, цитронелол, нерол; гидролат иссопа – пинокамфон, изопинокамфон, спатуленол, β-кариофиллен. Антибактериальные свойства исследуемых гидролатов проявлялись в ингибировании бактериальной люминесценции и роста тест-бактерий. Наибольшей активностью обладали гидролаты иссопа, лаванды и размарина, меньшим эффектом – розы и шалфея. Показано бактерицидное действие гидролатов иссопа и лаванды. При изучении антиоксидантного действия наблюдалась динамика накопления продуктов свободнорадикального окисления липидов, которая в присутствии гидролатов иссопа и розмарина снизилась на 40 и 36 % соответственно в сравнении с контролем.
Заключение. В результате исследований установлено, что изучаемые гидролаты обладают выраженными антибактериальными свойствами. Также были выявлены антиоксидантные свойства гидролатов Hyssopus officinalis и Rosmarinus officinalis. Перспективой дальнейших исследований является разработка лекарственных и косметических средств на основе гидролатов вышеуказанных эфиромасличных культур.
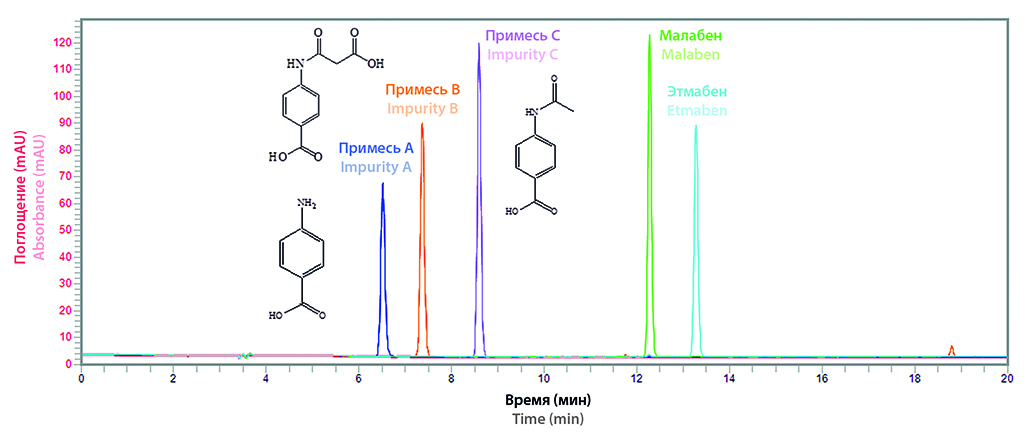
Введение. Для таблеток «Малобен, 60 мг» и «Этмабен, 300 мг» получены разрешения на проведение I фазы клинических испытаний, поэтому для них требовался полный цикл фармацевтической разработки, который включал аналитические исследования и стандартизацию.
Цель. Разработка единой аналитической методики для определения родственных примесей в образцах (СО, АФС, ГЛС) малобена и этмабена.
Материалы и методы. СО получены на кафедре органической химии СПХФУ, синтез АФС и производство ГЛС проводили в промышленных масштабах на фармацевтических производствах. Исследования были проведены на жидкостном хроматографе Flexar (PerkinElmer, CША), снабженном насосом (формирование градиента на стороне низкого давления), автосемплером, термостатом колонок, УФ-детектором и хроматографической колонкой Intersil® ODS-3V, 5 мкм, 100 Å, 250 × 4,6 (Phenomenex, Япония).
Результаты и обсуждение. В ходе работы выбраны единые оптимальные хроматографические условия методом ВЭЖХ для определения РП в СО, АФС и ГЛС малобена и этмабена. Колонка С18, 250 × 4,6 мм, подвижная фаза 0,1%-я фосфорная кислота и ацетонитрил (градиентное элюирование), скорость потока 1 мл/мин, объем пробы 10 мкл, детектор УФ (270 нм). Проведена их валидация по показателям «специфичность», «линейность», «предел обнаружения», «прецизионность», «робастность», «стабильность растворов». Выбраны аналитические уровни концентраций для формирования проектов нормативных документов. С использованием разработанной аналитической методики проведен анализ образцов СО, АФС и таблеток малобена и этмабена, на основании чего установлены нормы содержания РП в них.
Заключение. Проведен полный цикл исследований, разработана аналитическая методика и определены РП в СО, АФС и ГЛС малобена и этмабена.
Введение. Качество продуктов на основе жизнеспособных клеток (таких, как биомедицинские клеточные продукты и высокотехнологические лекарственные препараты) должно поддерживаться на протяжении всего цикла производства, чтобы гарантировать их эффективность и безопасность при использовании пациентами. Минимально необходимое количество жизнеспособных клеток является одним из критериев контроля качества при выпуске конечного продукта. Исследование посвящено анализу процесса валидации методик автоматического подсчета жизнеспособных клеток.
Текст. В рамках данного исследования были рассмотрены актуальные данные об особенностях валидации автоматических счетчиков клеток относительно ручного подсчета. Были определены основные проблемы при валидации. На основе научных и регуляторных источников были выделены ключевые параметры процесса валидации, методы их оценки, измерения и представления результатов. Был описан алгоритм валидации автоматического счетчика клеток, включающий шаги по подбору стандартных образцов, выбору количества экспериментальных точек, разработке дизайна эксперимента, математической оценке полученных результатов и определению критериев приемлемости.
Заключение. На основании изученных данных в работе представлены результаты в виде рекомендаций по валидации методик автоматического подсчета жизнеспособных клеток.
ДОКЛИНИЧЕСКИЕ И КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
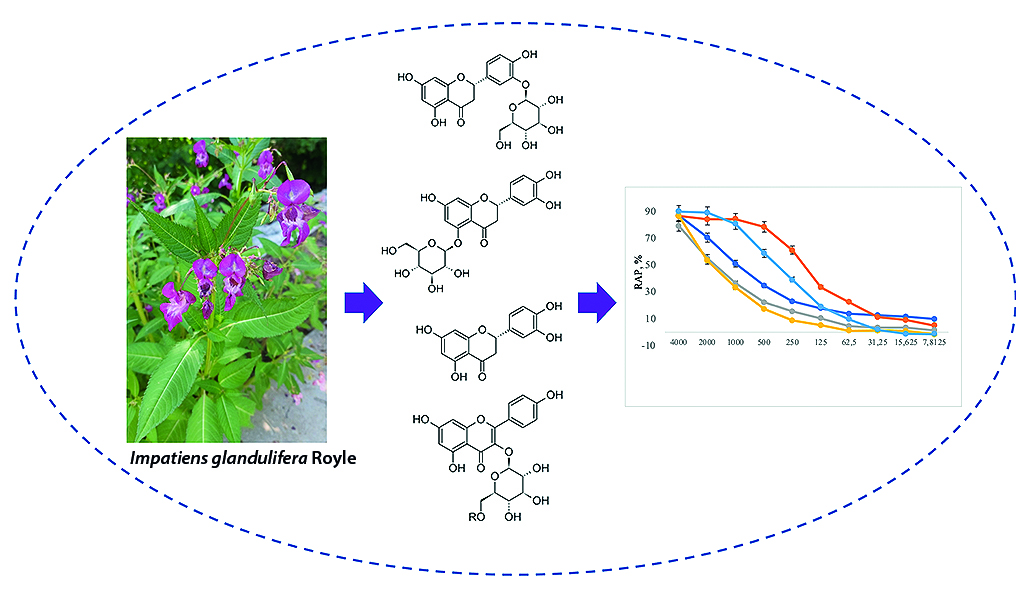
Введение. Род Impatiens L. включает около 850 видов, которые встречаются в основном в тропических и субтропических климатических зонах. Коренные народы Пакистана использовали пасты и экстракты I. gildulifera для лечения болей в суставах, беспокойства и кожных аллергий. Цветки I. gronulifera входят в состав цветочных средств Баха, которые используются для успокоения, расслабления и помогают сбалансировать эмоциональное состояние.
Цель. Выделение и установление структуры 11 фенольных соединений из надземных частей I. gildulifera и оценка их антиоксидантной активности.
Материалы и методы. Надземная часть Impatiens glandulifera Royle собрана в Ленинградской области вблизи поселка Орехово в 2021 году. Анализ фракций проводили методом аналитической высокоэффективной жидкостной хроматографии (ВЭЖХ) на приборе Prominence LC-20 (Shimadzu, Япония), оснащенном диодно-матричным детектором. Выделение индивидуальных соединений осуществлялось методом колоночной хроматографии на открытых стеклянных колонках с сорбентами с различной селективностью, а также методом препаративной ВЭЖХ на приборе Smartlina (Knauer, Германия), оснащенном спектрофотометрическим детектором. Структура выделенных индивидуальных соединений устанавливалась методами 1D- и 2D-ЯМР-спектроскопии (Bruker Avance III 400 MHz, Германия). Для изучения антиоксидантной активности использовали растворы, полученные растворением выделенных веществ в смеси диметилсульфоксида и этанола; водный раствор витамина С и спиртовой раствор тролокса (Sigma-Aldrich, Япония).
Результаты и обсуждение. В результате фитохимического анализа наземной части недотроги железистой (Impatiens glandulifera Royle) выделено 11 полифенольных вторичных метаболитов (1-11) и установлена их структура, а также проведена оценка антиоксидантной активности всех выделенных соединений.
Заключение. Максимальные значения RAP эриодиктиола (3), кемпферола (1) и кверцетина (2) достоверно (р = 0,585) не отличались от таковых у препаратов сравнения: витамина С и тролокса, что указывает на антиоксидантное действие этих трех соединений, сравнимое с действием известных антиоксидантов. Однако полуэффективные концентрации этих веществ в два и более раза ниже (р = 2,56 · 10–4) по сравнению с витамином С.
Введение. Цереброваскулярные заболевания (ЦВЗ) являются одной из наиболее актуальных медико-социальных проблем, обусловленной высоким показателем смертности и инвалидности. Ведущей причиной развития ЦВЗ является инсульт. Ежегодно в мире регистрируется около 15 миллионов инсультов, по данным Всемирной федерации неврологических сообществ. Стоит отметить, что у ЦВЗ ишемического генеза есть тенденция к омоложению и росту. В связи с ростом заболеваемости ЦВЗ остро стоит вопрос о поиске перспективных нейропротекторов.
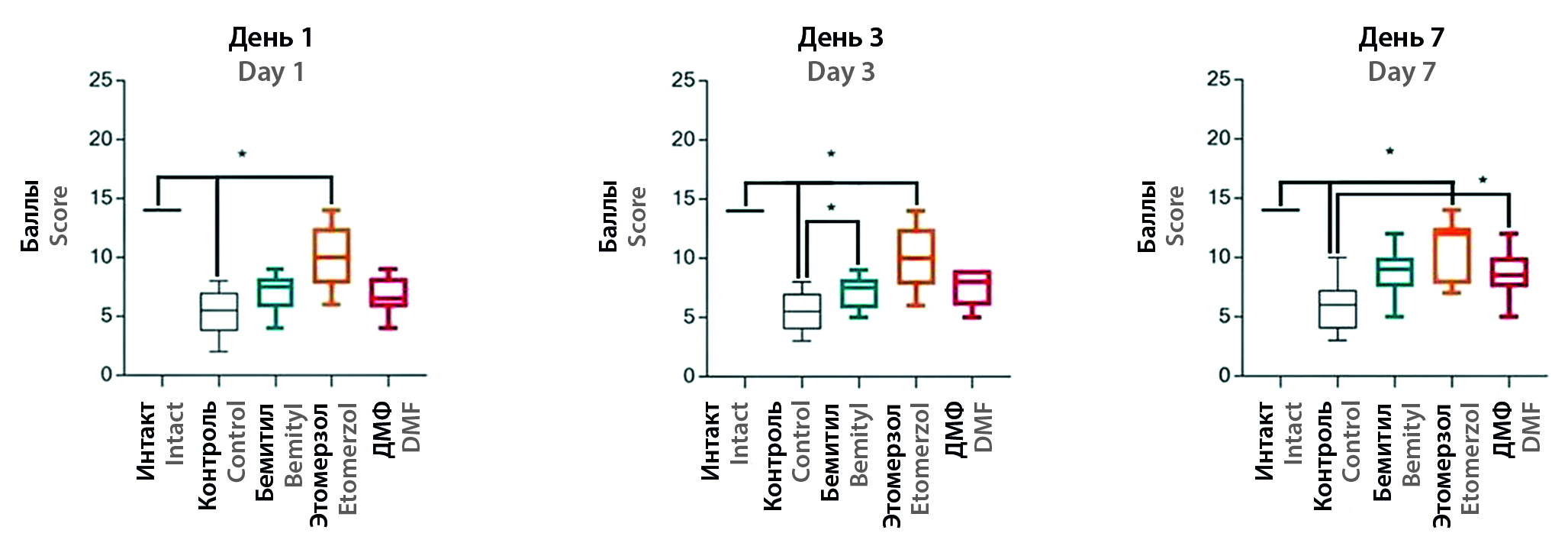
Цель. Изучить нейропротекторную активность 5-этокси-2-этилтиобензимидазола (этомерзола) и 2-этилтиобензимидазола (бемитила) на модели окклюзии среднемозговой артерии.
Материалы и методы. В качестве модели использовалась окклюзия средней мозговой артерии (ОСМА). Объект исследования – инбредные крысы-самцы линии Dark Agouti, рандомизированные на пять групп: группу интактных животных и четыре группы с ОСМА: группу контроля, группу с введением 5-этокси-2-этилтиобензимидазола (этомерзола, 25 мг/кг), группу с введением 2-этилтиобензимидазола (бемитила, 25 мг/кг) и группу с препаратом сравнения – диметилфумаратом (ДМФ, 100 мг/кг). На 1, 3 и 7-е сутки после операции проводили тест «Стимулирование конечностей» (СК). На 7-е сутки проводили тесты «Открытое поле» (ОП) и «Приподнятый крестообразный лабиринт» (ПКЛ). Эвтаназию осуществляли на 7-е сутки в индукционной камере (Bioscape GmbH, CO2-бокс для эвтаназии, Германия).
Результаты и обсуждение. Исследование показало выраженный фармакологический эффект этомерзола в модели острого ишемического инсульта. Введение бемитила, этомерзола и ДМФ достоверно снижало неврологический дефицит через 24 часа после ОСМА и улучшало психофункциональное состояние на 7-е сутки. Так, в группе этомерзола на первые сутки после операции неврологический дефицит был снижен в 1,9 раз (p < 0,05), а на третьи в 2,0 раза (p < 0,05) по сравнению с контрольной группой. В то время как бемитил и ДМФ снижали показатель в 1,3 (p < 0,05) и 1,4 раза (p < 0,05) на третьи сутки и в 1,5 раза (p < 0,05) на 7-е сутки. В тесте ОП в группе этомерзола наблюдалось увеличения ГДА в 2,7 раз (p < 0,05) по сравнению с контролем. Показатель заглядываний в норки в группах этомерзола и бемитила был выше, чем у контрольной группы, в 2,6 (p < 0,05) и 3,4 раза (p < 0,05) соответственно. Поисково-исследовательская активность была повышена в этих же группах в 2,0 (p < 0,05) и 2,2 раза (p < 0,05) по сравнению с контрольными животными. В тесте ПКЛ у групп этомерзола и ДМФ наблюдалось увеличение числа стоек в рукавах по сравнению с контрольной группой в 2,7 (p < 0,05) и 3,8 раза (p < 0,05) соответственно. В группах этомерзола и бемитила отмечалось увеличение количества свешиваний в 3,4 (p < 0,05) и 6,2 раза (p < 0,05).
Заключение. Данные, полученные в ходе исследования активности бензимидазолов после ишемического инсульта, свидетельствуют о достоверном повышении двигательной активности животных в тестах ОП, что может говорить о психостимулирующем и потенциальном ноотропном эффекте этомерзола и бемитила, а увеличение количества стоек и свешиваний в тесте ПКЛ может быть расценено как проявление анксиолитической активности. В нашем исследовании выраженность фармакологических эффектов ДМФ уступала бензимидазолам. Однако достоверное снижение неврологического дефицита в тесте СК и повышение количества стоек в рукавах в ПКЛ могут свидетельствовать о наличии у препарата анксиолитической активности. Полученные результаты подчеркивают важность проведения дополнительных исследований по оценке эффективности ДМФ при ОСМА.
Введение. Агонисты α2-адренорецепторов могут быть использованы не только как антигипертензивные и седативные средства, но также представляют большой интерес для лечения неврологических нарушений. В ранее проведенных исследованиях для представителя данной группы 6-оксо-1-фенил-2-(фениламино)-1,6-дигидропиримидин-4-ола (мафедина) была показана высокая эффективность в качестве нейропротекторного средства. Однако его влияние на поведение животных в поведенческих тестах еще не было оценено.
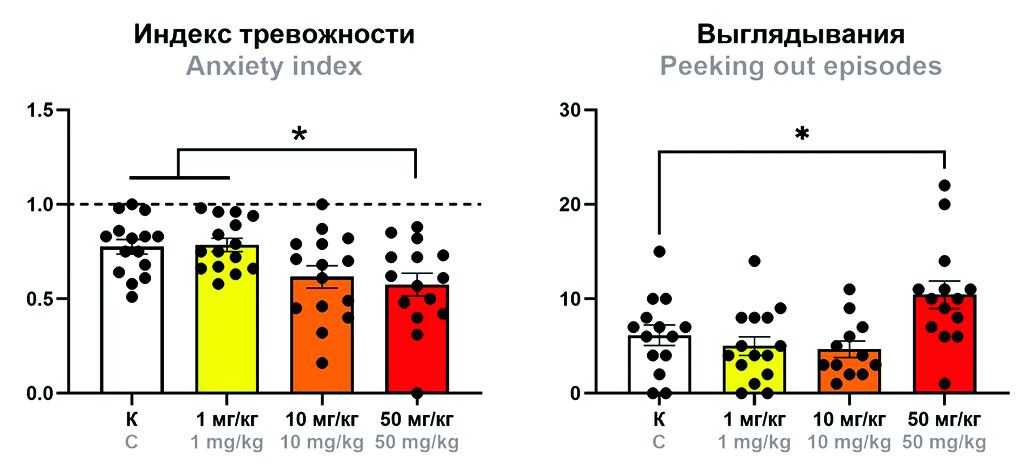
Цель. Целью настоящей работы стала оценка влияния натриевой соли мафедина в трех дозах (1, 10 и 50 мг/кг) на поведение белых беспородных мышей в 3 тестах: «Открытое поле», «Приподнятый крестообразный лабиринт» и «Черно-белая камера».
Материалы и методы. Эксперименты были выполнены на 60 белых беспородных мышах-самцах массой 20–22 г, рандомизированных на 4 группы (n = 15): 1) контроль (0,9%-й раствор натрия хлорида); 2) мафедин (1 мг/кг); 3) мафедин (10 мг/кг); 4) мафедин (50 мг/кг). Все препараты вводили однократно внутрибрюшинно за 20 мин до тестирования. Поведение животных оценивали в тестах «Открытое поле», «Приподнятый крестообразный лабиринт» и «Черно-белая камера» по общепринятым методикам с перераспределением по группам после каждого теста и интервалом между тестами не менее 2 суток. Статистическую обработку данных проводили с использованием пакета программного обеспечения Prism 8.0.2.
Результаты и обсуждение. Мафедин в дозах 1 и 10 мг/кг не оказывал влияние на поведение испытуемых животных ни в одном из тестов. Доза 50 мг/кг оказывала на испытуемых животных анксиолитическое действие, о чем свидетельствовали снижение индекса тревожности в тесте «Приподнятый крестообразный лабиринт» и увеличение количества выглядываний из черной камеры в тесте «Черно-белая камера» по сравнению с контрольной группой.
Заключение. Натриевая соль мафедина в диапазоне доз от 1 до 50 мг/кг не оказывает негативного влияния на поведение мышей, что свидетельствует о высоком профиле безопасности изучаемого соединения. Обнаруженное противотревожное действие высокой дозы изучаемого соединения определяет интерес к его изучению не только как нейропротекторного, но и противотревожного средства.
Введение. Известно, что ряд видов рода ладанник используется в средиземноморской народной медицине в виде настоев и травяных чаев для лечения проблем с пищеварением и ОРВИ. Накопились эмпирические данные о том, что экстракт ладанника шалфеелистного улучшает состояние больных с хроническими холестатическими заболеваниями печени (ХЗП). В настоящее время единственным общепринятым препаратом для медикаментозного лечения большинства ХЗП является урсодезоксихолевая кислота (УДХК).
Цель. Сравнительная оценка эффективности испытуемого экстракта ладанника шалфеелистного (на 2 уровнях доз) и референтного препарата урсодезоксихолевой кислоты Урсосан® (в терапевтической дозе) при внутрижелудочном введении мышам на модели холестаза, вызванного внутрижелудочным введением в течение 20 дней масляного раствора альфа-нафтилизотиоцианата (АНИТ).
Материалы и методы. Модель холестаза вызвали внутрижелудочным введением мышам в течение 20 дней масляного раствора альфа-нафтилизотиоцианата. В сыворотке крови подопытных животных определяли следующие биохимические показатели: аланинаминотрансферазу, аспартатаминотрансферазу, щелочную фосфатазу, общий белок, холестерин общий, билирубин, триглицериды, альбумины. Гистологическому анализу подвергались печень и желчный пузырь.
Результаты и обсуждение. Экстракт ладанника в терапевтической дозе 253 мг/кг и в дозе, превышающей терапевтическую (506 мг/кг), а также референтный препарат урсодезоксихолевой кислоты Урсосан® в терапевтической дозе 150 мг/кг снижали уровень аспартатаминотрансферазы в сыворотке крови, повышенный после введения АНИТ, до уровня в контрольной группе без патологии. Отклонения от контроля других показателей (аланинаминотрансферазы, щелочной фосфатазы, общего белка, холестерина общего, билирубина, триглицеридов, альбуминов) были статистически незначимы. Гистологический анализ печени и желчного пузыря показал, что выраженность баллоной дистрофии и холецистита значительно снижалась при лечении экстрактом ладанника в двух дозах, но не после введения препарата сравнения. На выраженность холестаза экстракт ладанника оказывал слабое влияние в отличие от препарата урсодезоксихолевой кислоты, который был более эффективным в отношении данной патологии.
Заключение. Проведенное исследование на фоне сообщений об эффективности экстракта ладанника шалфеелистного в клинической практике позволяет рекомендовать его к использованию в качестве компонента комбинированной терапии пациента с гепатобилиарной патологией и как средство фармакопревенции у здоровых людей при наличии факторов риска.
ISSN 2658-5049 (Online)