МЕТОДЫ АНАЛИЗА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Введение. Синюха голубая является единственным представителем семейства синюховых, который допустим к использованию в медицинской практике. Синюхи голубой корневища с корнями применяются в качестве отхаркивающего и седативного средства и включены в Государственную фармакопею XIV изд. Трава растения используется в качестве биологически активной добавки седативного действия, однако нормативная документация на данный вид сырья до настоящего времени не разработана.
Цель. Описание анатомических признаков, необходимых при разработке проекта фармакопейной статьи для формирования раздела «Микроскопия» и оценки подлинности растительного сырья «Синюхи голубой трава».
Материалы и методы. В работе использовались несколько образцов синюхи голубой травы, которые были собраны самостоятельно от культивируемых растений (Polemonium cаeruleum L.) в 2022 и 2023 гг. в период массового цветения на территории Ботанического сада им. Б. М. Козо-Полянского ФГБОУ ВО ВГУ (Воронеж). Микроскопический анализ выполняли в соответствии с требованиями действующей нормативной документации.
Результаты и обсуждение. Установлено, что эпидермальные клетки листа, чашечки и венчика синюхи голубой извилистые, на цветоносах – вытянутые. Трихомы двух типов. По краю листа и на чашелистиках находятся сосочковидные выросты эпидермиса. Мезофилл снизу листа представлен губчатой тканью. Проводящая система преимущественно спирального типа утолщения. Устьица аномоцитного типа. Стебель округлый или со слабо выраженными гранями. Первичная кора стебля представлена колленхимой, запасающей паренхимой без включений, эндодермой с поясками Каспари. Стела беспучкового строения. Камбий состоит из сплошных рядов мелких клеток. Флоэма представлена мелкими клетками. Во вторичной ксилеме отсутствуют сердцевидные лучи, радиально расположенные сосуды имеют толстые стенки. Сердцевина представлена клетками паренхимы с каплями масла. Черешок в очертании треугольный, с глубокой выемкой сверху и длинными краевыми выростами, где находится по одному мелкому проводящему пучку. Центральный пучок в форме дуги с загнутыми вовнутрь краями с паренхимной обкладкой.
Заключение. В рамках настоящего исследования с помощью различных приемов микроскопического анализа изучены анатомо-диагностические признаки синюхи голубой травы. Полученные данные будут использованы при разработке проекта фармакопейной статьи «Синюхи голубой трава», а именно для формирования раздела «Микроскопия».
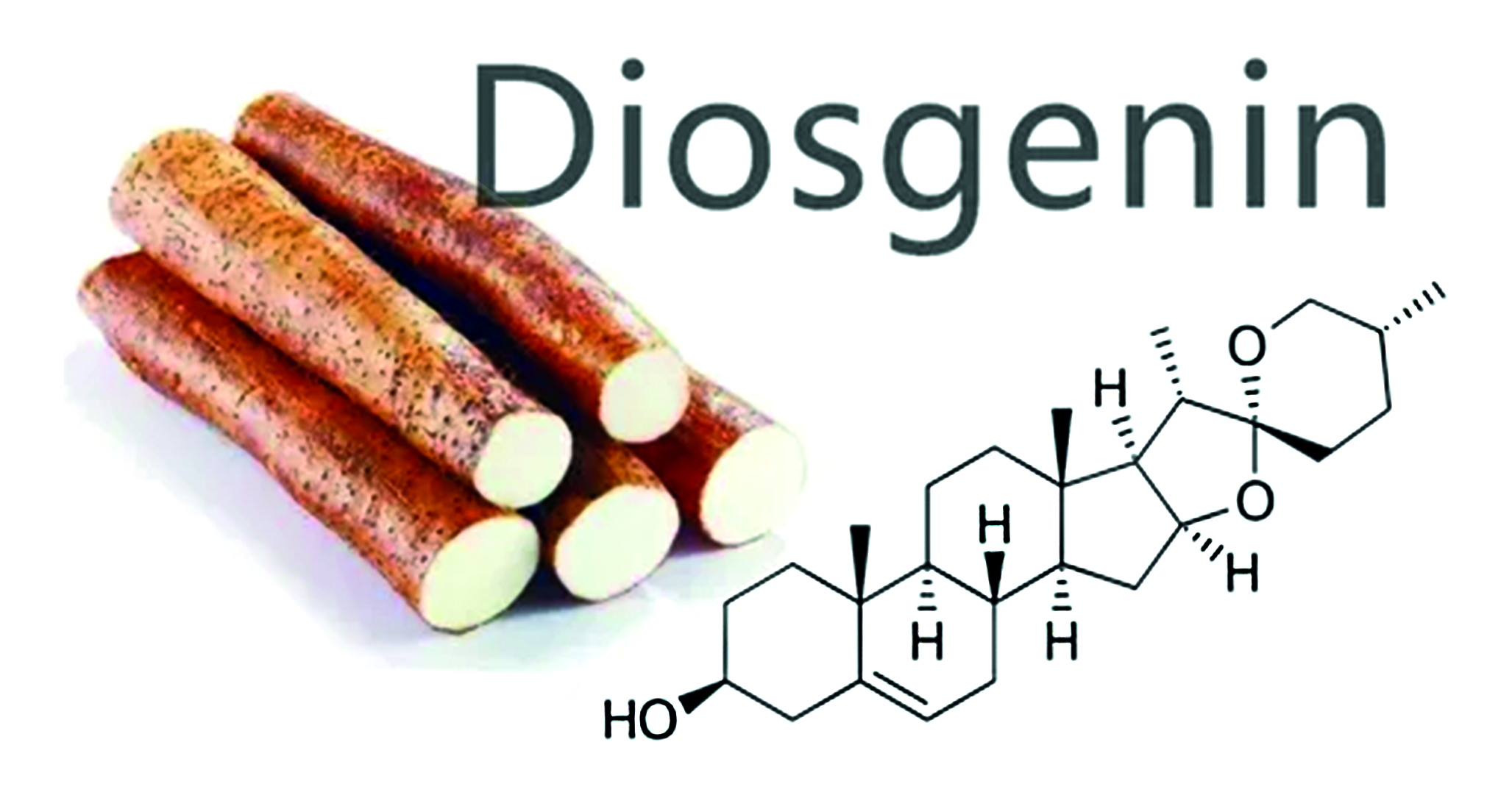
Введение. В оригинальной статье представлены результаты экспериментального исследования, проведенного с использованием метода высокоэффективной тонкослойной хроматографии (ВЭТСХ), растительных образцов – корневищ с корнями Dioscorea caucasica Lipsky, Dioscorea nipponika Makino. Данные виды диоскорей используются в различных областях медицины в качестве фунгицидного, антимикробного, а также антисклеротического средства. Метод ВЭТСХ используется на этапе скрининга растительных образцов для предварительной идентификации и денситометрического количественного определения диосгенина в растительных экстрактах.
Цель. Разработка ВЭТСХ-методики количественной оценки содержания диосгенина после проведения кислотного гидролиза экстрактов в воздушно-сухом сырье – корневищах с корнями Dioscorea caucasica Lipsky, Dioscorea nipponika Makino.
Материалы и методы. Экстракты получали путем предварительного обезжиривания и депигментирования воздушно-сухого сырья корневищ с корнями изучаемых видов диоскорей дихлорметаном х.ч. с последующим двойным экстрагированием. Первое экстрагирование проводили в среде 50%-го водного раствора изопропанола х.ч. при озвучивании ультразвуком с последующим проведением кислотного гидролиза О-гликозидных связей, упариванием. Второе экстрагирование проводили путем перерастворения сухого остатка в метаноле х.ч.; очищали от взвешенных частиц фильтрованием через шприцевые фильтры с диаметром перфораций 20 мкм. ВЭТСХ осуществляли на аппаратном комплексе CAMAG (Швейцария) с использованием пластин HPTLC Aluminium sheets Silica gel 60 F254, 20 × 20 см, которые разрезали до размера 20 × 10 см.
Результаты и обсуждение. После проведения сканирующей денситометрии при 366 и 542 нм было установлено, что хроматографирование метанольных извлечений в системе растворителей толуол х.ч. – хлороформ х.ч. – ацетон х.ч. (2 : 8 : 2 по объему) позволяет удовлетворительно провести разделение и последующее денситометрическое количественное определение диосгенина. Сравнение треков растительных экстрактов корневищ с корнями Dioscorea caucasica Lipsky и Dioscorea nipponika Makino проводили со стандартным образцом диосгенина.
Заключение. Проведенное исследование позволило установить, что содержание стероидного сапогенина диосгенина в воздушно-сухом сырье Dioscorea nipponica Makino (286,4–296,3 мкг/г) незначительно преобладает над его содержанием в сырье Dioscorea caucasica Lipsky (257–277,1 мкг/г). Полученные количественные значения, рассчитанные раздельно по высоте и площади пиков, демонстрируют хорошую сходимость, что подтверждает корректность методики. Разработанный метод высокоэффективной тонкослойной хроматографии с денситометрическим детектированием диосгенина может быть рекомендован для рутинного количественного анализа данного соединения в растительном сырье.
ДОКЛИНИЧЕСКИЕ И КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Введение. Нарушения в функционировании ЦНС, возникающие при хроническом употреблении этанола, часто связаны с угнетением полноценного нейрогенеза. При этом одними из ведущих сигнальных каскадов, задействованных в регуляции пролиферации и дифференцировки нейральных и нейрональных стволовых клеток, считаются GPCR/cAMP-зависимый путь и JAK/STAT-сигналинг. Очевидно, что поиск принципиально новых подходов к терапии этаноловой нейродегенерации, путем воздействия на внутриклеточные сигнальные молекулы, весьма актуален и востребован для практической медицины.
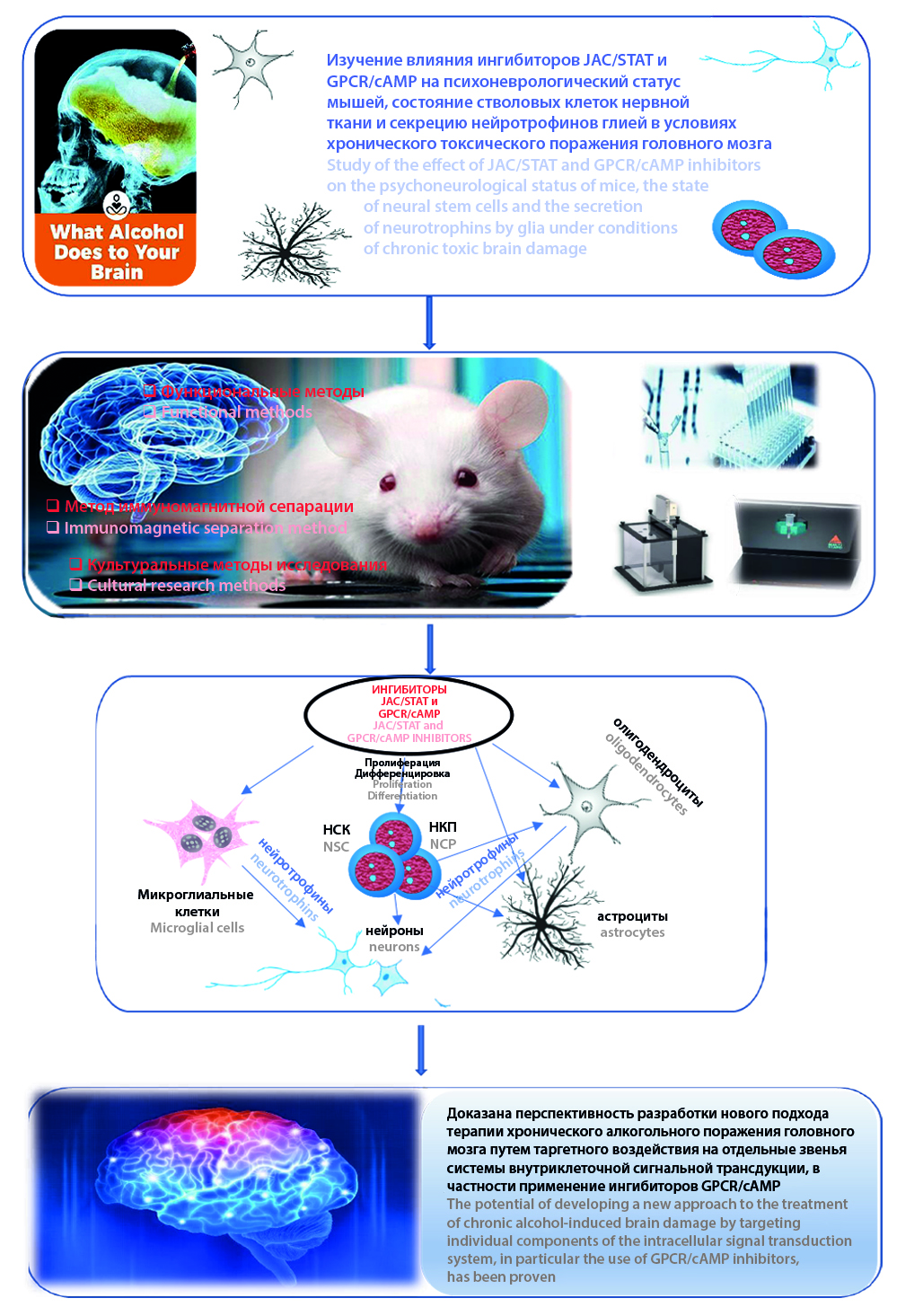
Цель. Целью данного исследования явилось изучение влияния ингибиторов JAC/STAT и GPCR/cAMP на психоневрологический статус мышей, состояние стволовых клеток нервной ткани и секрецию нейротрофинов глией в условиях хронического токсического поражения головного мозга.
Материал и методы. Исследования проведены на 90 мышах линии С57BL/6. Алкогольную нейродегенерацию моделировали введением per os 30%-го раствора С2Н5ОН в дозе 3 г/кг/сут в течение 8 недель. Ингибиторы JAC/STAT и GPCR/cAMP вводили подкожно 1 раз в сутки в течение 7 дней в дозе 15 и 10 мкг/кг соответственно. Психофармакологические эффекты блокаторов оценивали в тесте «Открытое поле» и по степени сохранности условного рефлекса пассивного избегания. Культуральными методами изучали содержание нейральных стволовых клеток и коммитированных нейрональных предшественников в субвентрикулярной зоне головного мозга, их пролиферативную активность и интенсивность созревания, исследовали продукцию нейротрофных факторов клетками глии.
Результаты и обсуждение. Введение ингибиторов JAC/STAT и GPCR/cAMP корригировало функциональные признаки патологии мозга алкогольного генеза (наблюдалась отмена изменений ориентировочно-исследовательского поведения). При этом курсовое применение ингибитора GPCR/cAMP нивелировало, а введение блокатора JAC/STAT усугубляло снижение уровня воспроизведения условного рефлекса пассивного избегания у алкоголизированных мышей. В группах животных, получавших ингибиторы JAC/STAT и GPCR/cAMP, отмечалось возрастание числа нейральных стволовых клеток и коммитированных нейрональных предшественников, сопровождающееся повышением их митотической активности и интенсивности специализации. Введение ингибитора GPCR/cAMP после моделирования этанолиндуцированного поражения головного мозга сопровождалось повышением секреции нейротрофинов астроцитами и микроглией.
Заключение. Полученные результаты указывают на перспективность разработки нового подхода к терапии хронического алкогольного поражения головного мозга путем таргетного воздействия на отдельные звенья системы внутриклеточной сигнальной трансдукции, в частности применение ингибиторов GPCR/cAMP.
Введение. Функциональные печеночные пробы являются актуальной группой методик скрининговой оценки состояния печени, применимых как в лабораторных исследованиях, так и в клинической практике. В эту группу в том числе входит проба Квика – Пытеля, основанная на ферментативной реакции образования гиппуровой кислоты из глицина и бензоата в печени. Эта проба отличается малой инвазивностью и сравнительной простотой выполнения, однако в настоящий момент отсутствует детализированный протокол ее проведения у мелких лабораторных животных.
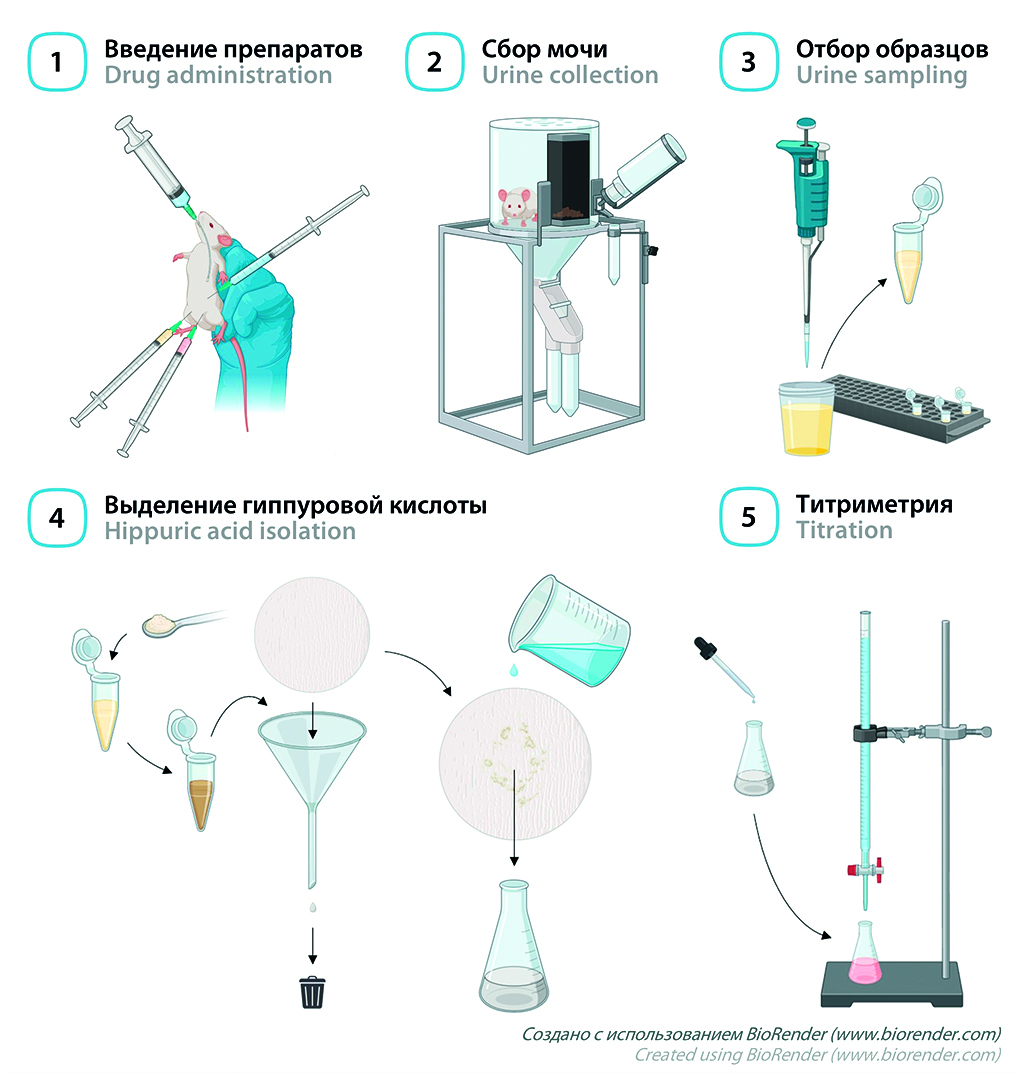
Цель. Целью работы являлась адаптация протокола пробы Квика – Пытеля для оценки антитоксической функции печени у мышей.
Материалы и методы. Белым беспородным мышам-самцам (n = 10) вводили внутрибрюшинно нагрузочные дозы натрия бензоата и глицина в эквимолярном соотношении (504 мг/кг и 264 мг/кг соответственно), после чего в течение 18 ч собирали мочу в метаболических клетках. После пробоподготовки титровали образовавшуюся гиппуровую кислоту 0,01 Н раствором калия гидроксида в присутствии 1%-го раствора фенолфталеина. Через 1 неделю после измерения мышам вводили тетрахлорметан (1 мл/кг) для индукции острого токсического гепатита, после чего проводили пробу повторно. Поражение печени верифицировали гистологически с окрашиванием гематоксилином и эозином.
Результаты и обсуждение. После введения тетрахлорметана концентрация гиппуровой кислоты в моче статистически значимо (p < 0,01) снизилась более чем на 50 % от исходного уровня. В образцах печени при этом наблюдали характерную морфологическую картину острого токсического гепатита.
Заключение. Проведена адаптация протокола пробы Квика – Пытеля для мышей и подтверждена ее применимость для оценки антитоксической функции печени при остром поражении. Описанная в работе методика проста в исполнении, не требует существенных затрат и может быть использована для рутинной оценки функционального состояния печени у мелких лабораторных животных.
ФАРМАЦЕВТИЧЕСКАЯ ТЕХНОЛОГИЯ
Введение. Фармацевтическая разработка представляет собой сложнейшую комплексную работу, основной целью которой является достижение целевого профиля качества продукта (Quality Target Product Profile, QTPP). QTPP формулируется на основании целого комплекса требований к препарату, включая фармакопейные, потребительские, фармакологические и пр. Традиционный эмпирический подход к разработке состава и технологии лекарственной формы в данном случае представляется трудо- и ресурсоемким, при этом не позволяет в полной мере достичь понимания всех процессов как с точки зрения технологии, так и с точки зрения дальнейших этапов жизненного цикла лекарственного препарата (ЛП). Подход «качество через проектирование» (QbD) позволяет оценить влияние факторов на процессы, что, в свою очередь, способствует проактивному управлению рисками и созданию робастных технологий.
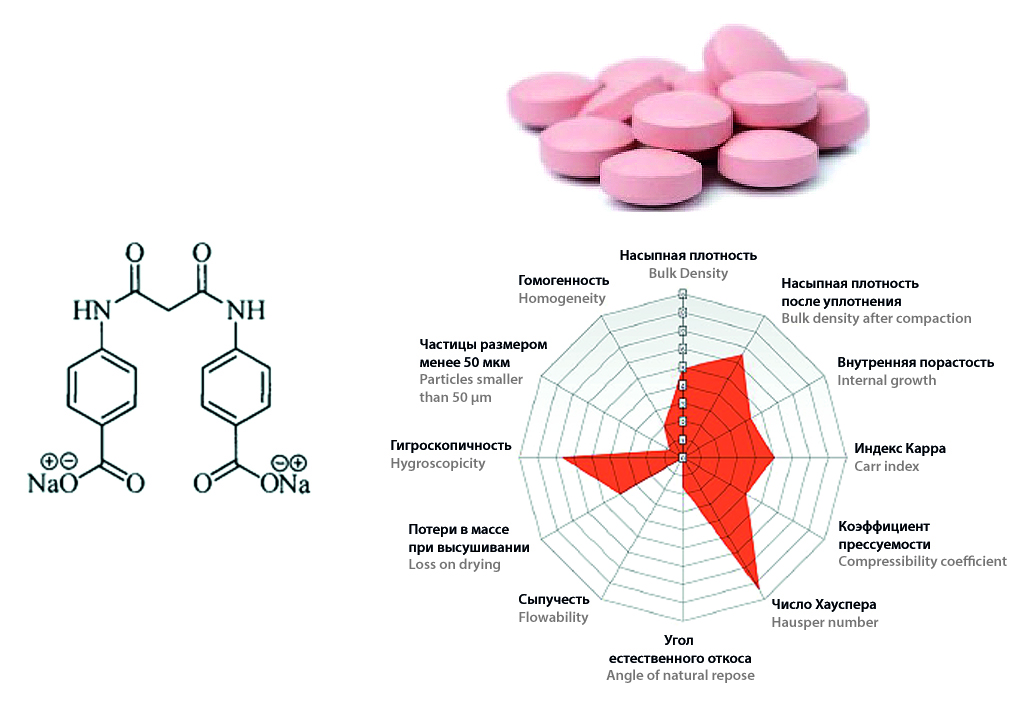
Цель. Продемонстрировать комплексное применение инструментов QbD, включая экспертные системы (Sediment Delivery Model, SeDeM), планирование экспериментов (Design of Experiment, DoE) и анализ рисков, на примере разработки состава таблеток пролонгированного действия на основе 4,4’-(пропандиамидо)дибензоата натрия.
Материалы и методы. В работе использована оригинальная активная фармацевтическая субстанция (АФС) – 4,4’-(пропандиамидо)дибензоат натрия, современные вспомогательные вещества и полимеры, обеспечивающие пролонгированное высвобождение (этилцеллюлоза, гидроксипропилметилцеллюлоза и пр.). На первом этапе для проектирования составов применялся метод SeDeM. На втором этапе для оптимизации профиля высвобождения использован скрининговый DoE.
Результаты и обсуждение. Метод SeDeM позволил количественно определить и нивелировать риски, связанные с неудовлетворительными технологическими свойствами АФС. Были спроектированы и экспериментально подтверждены составы с удовлетворительными технологическими свойствами. В результате DoE установлено, что ГПМЦ обеспечивает наиболее полное и равномерное высвобождение (более 80 % за 12 ч), приближенное к кинетике высвобождения нулевого порядка.
Заключение. Комплексное применение инструментов QbD позволило эффективно и обоснованно разработать робастный состав таблеток пролонгированного действия на основе 4,4’-(пропандиамидо)дибензоата натрия, обеспечивающий как требуемые технологические свойства, так и требуемый профиль высвобождения.
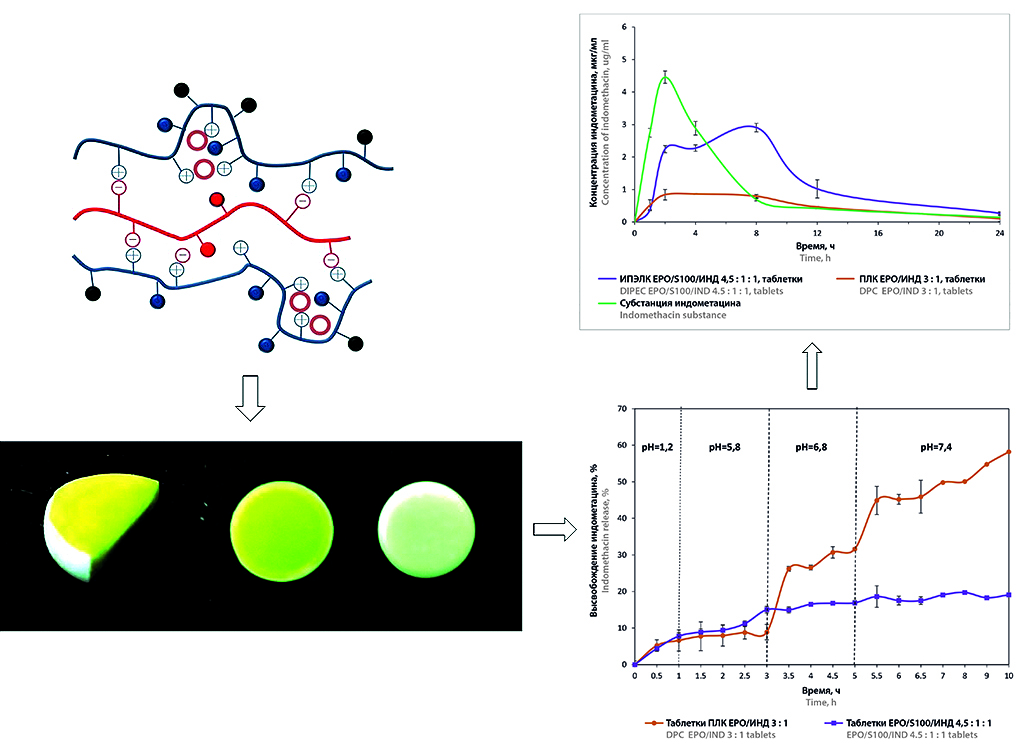
Введение. Интерполиэлектролитные комплексы (ИПЭК) – перспективные носители для систем с контролируемым высвобождением активных фармацевтических ингредиентов (АФИ). Введение АФИ ионного характера в системы доставки может приводить к образованию связей с полиэлектролитами, что оказывает влияние на высвобождение лекарственного вещества из лекарственной формы. Ранее были получены полимер-лекарственный комплекс на основе Eudragit® EPO с индометацином, а также интерполиэлектролит-лекарственный комплекс, образованный сополимерами Eudragit® EPO, Eudragit® S100 и индометацином. Проведена оценка физико-химических свойств оптимальных образцов и показана перспективность их использования в системах контролируемой доставки индометацина.
Цель. Сравнительная биофармацевтическая оценка полимер-лекарственного и интерполиэлектролит-лекарственного комплексов как систем пероральной направленной доставки индометацина.
Материалы и методы. Полимер-лекарственный комплекс на основе Eudragit® EPO и индометацина (ПЛК ЕРО/ИНД) и интерполиэлектролит-лекарственный комплекс на основе Eudragit® EPO, Eudragit® S100 и индометацина (ИПЭЛК ЕРО/S100/ИНД) получены при молярном соотношении компонентов 3 : 1 и 4,5 : 1 : 1 соответственно. Оценку высвобождения индометацина из порошков и таблеток ПЛК и ИПЭЛК проводили методом II («Лопастная мешалка») с использованием тестера растворения DT 828 (ERWEKA GmbH, Германия). Концентрацию индометацина определяли УФ-спектрофотометрически на спектрофотометре Lambda 25 (PerkinElmer, США) при длине волны 270 нм. Математическое моделирование высвобождения индометацина осуществляли с использованием программы Microsoft Excel Office. Фармакокинетические исследования проводили на кроликах породы советская шиншилла. Исследуемые образцы вводили перорально, через определенные интервалы времени отбирали пробы крови из ушной вены. Концентрацию индометацина в плазме крови определяли методом ВЭЖХ на хроматографе LC-20 Prominence (Shimadzu, Япония) с УФ-детектированием. Основные фармакокинетические показатели рассчитывали с использованием программы Thermo Kinetica® (version 5.0, build 5.00.11; Thermo Fisher Scientific, США).
Результаты и обсуждение. Профили высвобождения индометацина из порошков ПЛК и ИПЭЛК характеризуются как «кишечный тип», где превалирующим механизмом является процесс релаксации полимерных цепей при высвобождении субстанции. Высвобождение индометацина из таблетированной матрицы на основе ИПЭЛК отличается от профиля высвобождения из порошка ИПЭЛК и достигает 19 %. Профиль высвобождения индометацина из таблеток ПЛК EPO/ИНД сходен с профилем высвобождения из порошка и достигает 58 %. На поверхности таблеток ИПЭЛК образуется гидрогелевый слой, который препятствует проникновению среды растворения внутрь матрицы. Высвобождение индометацина из образцов ИПЭЛК ЕРО/S100/ИНД происходит за счет диффузии лекарственного вещества из матрицы. ПЛК и ИПЭЛК в виде порошков обладают большим средним временем удерживания (MRT) по сравнению с таблетками ПЛК и ИПЭЛК. MRT ИПЭЛК и ПЛК в виде порошка превышает MRT cубстанции индометацина в три и четыре раза соответственно. Максимальная концентрация индометацина в плазме крови кроликов при пероральном введении таблеток ИПЭЛК наблюдается через 8 часов эксперимента.
Заключение. Высвобождение индометацина из ПЛК EPO/ИНД происходит за счет наличия «дефектных» областей и релаксации полимерных цепей, это обеспечивает замедленный выход АФИ и невысокую относительную биодоступность, что позволяет использовать ПЛК в системах доставки индометацина для лечения воспалительных заболеваний толстого кишечника. Таблетированные системы ИПЭЛК EPO/S100/ИНД позволяют изменить профиль высвобождения индометацина за счет процессов диффузии субстанции через образующийся гидрогелевый слой на поверхности матрицы, обеспечивая высокую биодоступность, и могут быть использованы как матричные системы для доставки АФИ в оптимальную зону всасывания.
ЮБИЛЕЙ
НЕКРОЛОГ
ISSN 2658-5049 (Online)