ОТ РЕДАКЦИИ
26 и 27 февраля 2025 года в Москве пройдет ежегодный двухдневный конгресс «Разработка и регистрация лекарственных средств». Тематика конгресса традиционно охватывает все ключевые этапы жизненного цикла лекарственного средства, от разработки до пострегистрационных исследований.
Представляем вашему вниманию новое интервью в рамках цикла «Мнение лидеров». Сегодняшним гостем стала вице-президент по развитию бизнеса ГК «Фармасинтез» Наталья Малых. В роли интервьюера выступила Кульджанова Наталья Вячеславовна, директор научно-производственного журнала «Разработка и регистрация лекарственных средств».
Третья часть статьи посвящена обзору источников, отражающих функции Аптекарского приказа. К этим источникам ученые-историки относят: челобитные, памяти и отпуски (копии) с них, переписку с региональными властями, указы и указные царские грамоты, отписки воевод, приказные записи, росписи (перечни) предметов и людей, приказные книги, сказки и осмотры, приходные и расходные книги и сохранившиеся рецепты. Кроме того, в корпусе документов Аптекарского приказа встречаются выписки в доклад, допросные речи, копии судных дел, родословные росписи, разрядные, боярские писцовые книги и т. п. Анализ содержания этих источников позволяет установить роль Аптекарского приказа в структуре государственного управления аптечным делом.
«Кастомное» выделение – это разработка методики выделения и само выделение индивидуального соединения под заказ за определенный срок благодаря комбинации аналитических методов, учитывающих особенности конкретного растения и физико-химические свойства выделяемых компонентов.
МЕРОПРИЯТИЯ
7 октября 2024 года в рамках форума «БИОТЕХМЕД» состоялась главная пленарная сессия «Движение к технологическому лидерству – нацпроекты технологического суверенитета для здравоохранения».
ПОИСК И РАЗРАБОТКА НОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
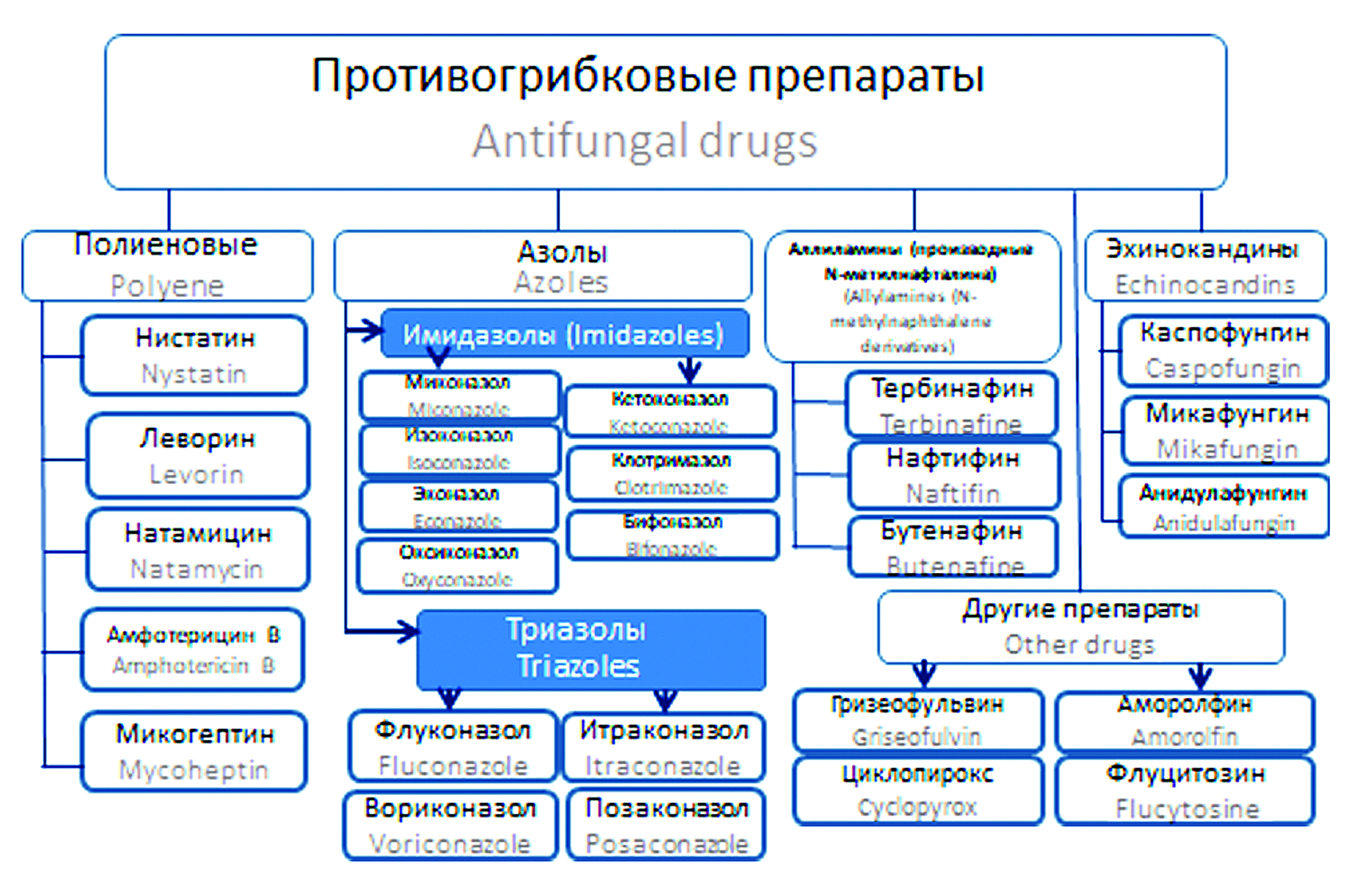
Введение. Сведения о микозах и противогрибковых препаратах современного типа зачастую носят отрывочный, несистематизированный характер, что требует корректировки.
Цель. Систематизировать новейшие сведения о грибах и микозах, средствах борьбы с ними и встречаемых на этом пути проблемах, осветить последние достижения в области синтеза и исследования активности 1,2,4-триазола как потенциального фунгицидного соединения.
Материалы и методы. Материалами служили опубликованные в передовых научных журналах исследования авторов, проведенные по всему миру, в области изучения грибов, противогрибковых препаратов, поиска новых противогрибковых средств.
Результаты и обсуждение. В статье представлен обзор современных сведений о морфобиологических особенностях грибов, актуализации их таксономии и номенклатуры, показана роль грибов в природе и развитии грибковых инфекций у человека и животных, структурированы сведения о классификации микозов и их возбудителях. Также приведены новейшие сведения о фармакологических свойствах основных существующих на настоящее время противогрибковых препаратов, механизмах формирования устойчивости к ним у грибов; в сравнительном аспекте с другими группами противомикотических препаратов показана перспективность азолов и их производных в качестве источников получения новых фунгицидных лекарственных и дезинфицирующих средств. Литературные исследования показали, что производные 1,2,4-триазола обладают широким спектром противогрибковой активности, которая распространяется и на другие виды активности.
Заключение. Значительная перспективность триазолов обусловлена в том числе и фунгицидным влиянием в отношении устойчивых штаммов грибов – возбудителей инфекций человека и животных. Преимуществом новых производных является и низкий уровень подавляющих грибы концентраций, низкая цитотоксичность, что позволяет в перспективе использовать их для внутривенного введения. Актуализация сведений о действенности новых противогрибковых соединений поможет исследователям систематизировать знания о свойствах азолов, что может способствовать поиску и разработке новых потенциальных кандидатов на противогрибковые препараты с высокой эффективностью и селективностью, способствовать формированию новых направлений исследований по поиску эффективных средств борьбы с микозами в различных сферах деятельности человека.
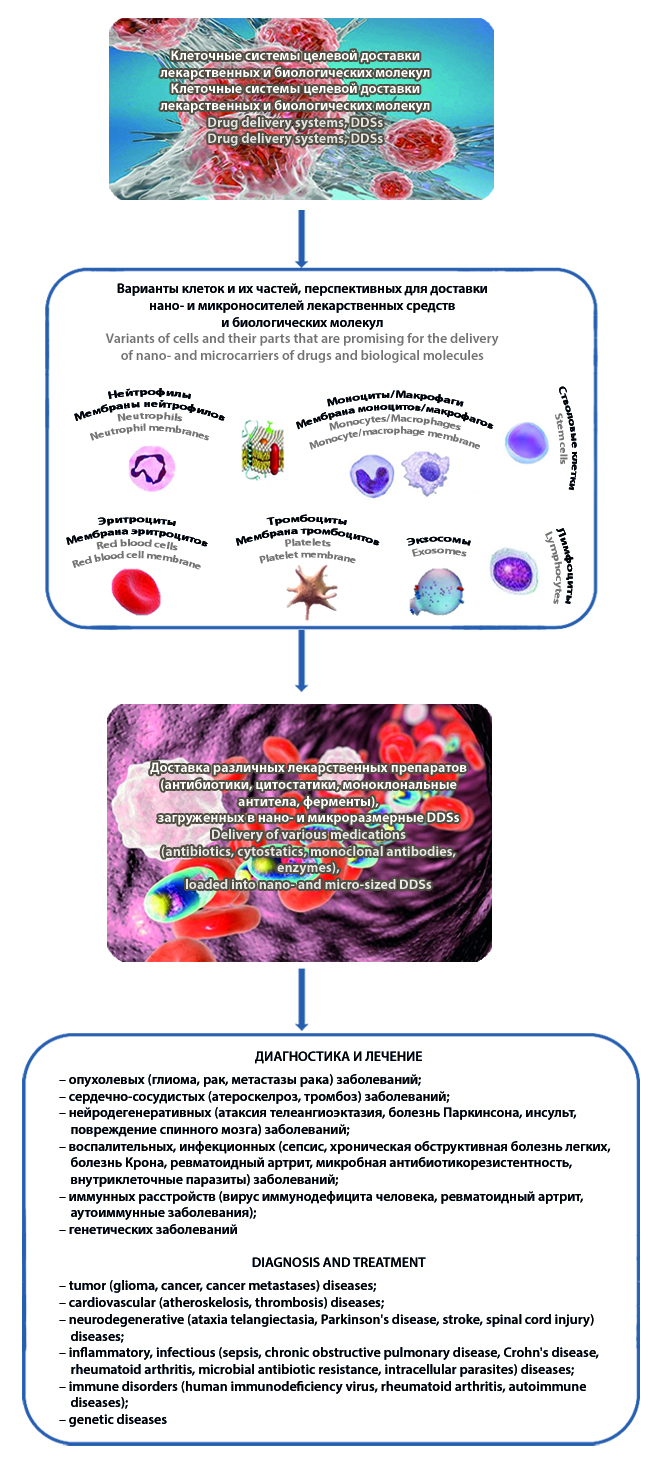
Введение. Клеточные системы целевой доставки лекарственных и биологических молекул (drug delivery systems, DDSs) рассматриваются в настоящее время как перспективное решение проблем нано- и микроразмерных носителей лекарственных препаратов.
Текст. В обзоре в сжатом виде рассмотрены фундаментальные и прикладные вопросы разработки клеточных DDSs, морфофункциональное разнообразие которых теоретически позволяет решать задачи фармакотерапии различных заболеваний. Представлены источники, суммирующие клинические протоколы применения клеточных DDSs, которые ограничены тем не менее противоопухолевой и противовоспалительной терапией. Описываются достоинства, а также частные и общие недостатки использования тех или иных клеток (клетки крови, иммуноциты, стволовые клетки) как перспективных платформ для трансляции в клиническую практику средств доставки различных лекарственных препаратов (антибиотики, цитостатики, моноклональные антитела, ферменты и т. п.), загруженных в нано- и микроразмерные DDSs.
Заключение. Несмотря на очевидные и впечатляющие успехи фундаментальных и прикладных исследований в данной области, впереди непростой путь оптимизации процессов таргетной доставки и контролируемого высвобождения лекарственных и биологических молекул с помощью клеточных DDSs.
ФАРМАЦЕВТИЧЕСКАЯ ТЕХНОЛОГИЯ
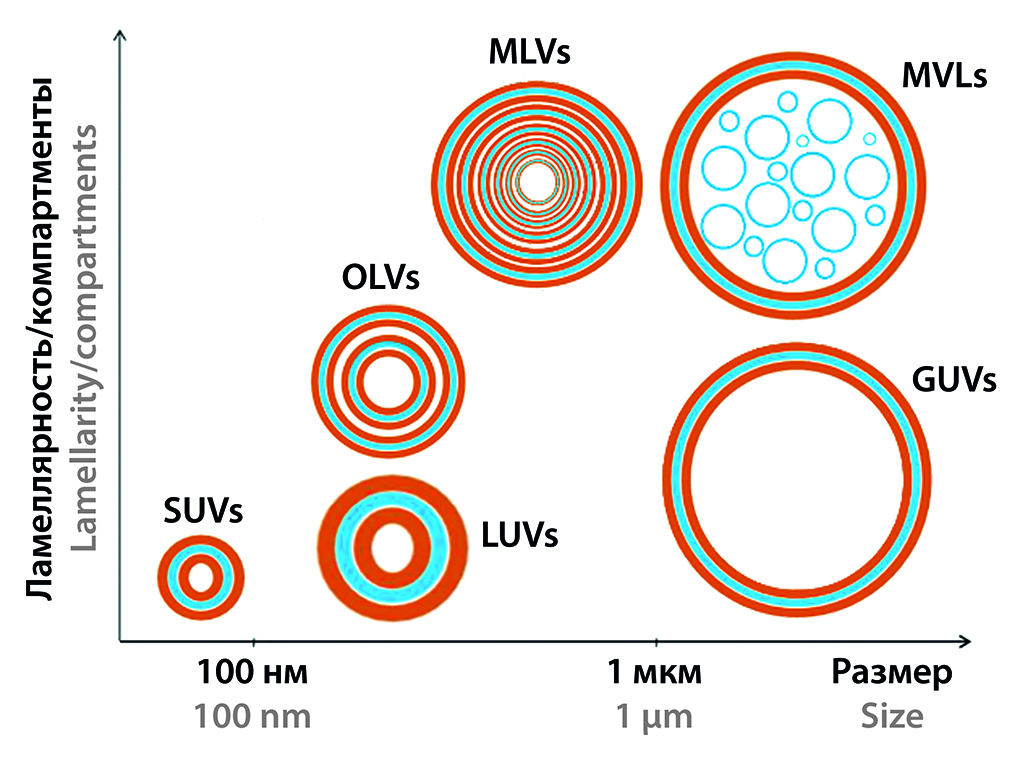
Введение. В данном обзоре рассмотрены вопросы современной классификации липосом, методов их изготовления, стабилизации и роли составных компонентов, визуализации, фармакокинетики. В первой части обсуждены первые три вышеупомянутых аспекта.
Текст. Липосомы являются не только перспективными наноконтейнерами для адресной доставки лекарственных средств, но и метаболически активными комплексами с широким спектром активности. Липидные компоненты липосом могут оказать выраженное действие на органы и ткани-мишени. Продукты метаболизма основных компонентов липосом обладают собственной биологической активностью, зависящей от их сочетания и дозировки. Все вышесказанное свидетельствует о перспективности использования липосом не только в качестве носителей ЛС, но и в качестве самостоятельных эффекторов, способных оказать значительное влияние на метаболизм человека при различных заболеваниях. Проведено сравнение преимуществ и ограничений методов получения липосом, рассмотрены особенности изготовления стелс-липосом. Отдельно обсуждены вопросы стабилизации липосом.
Заключение. Обсужденная в обзоре информация может быть полезна при разработке лекарственных средств в форме липосом.
Введение. Во второй части обзора рассмотрены вопросы визуализации, фармакокинетики и биораспределения липосом.
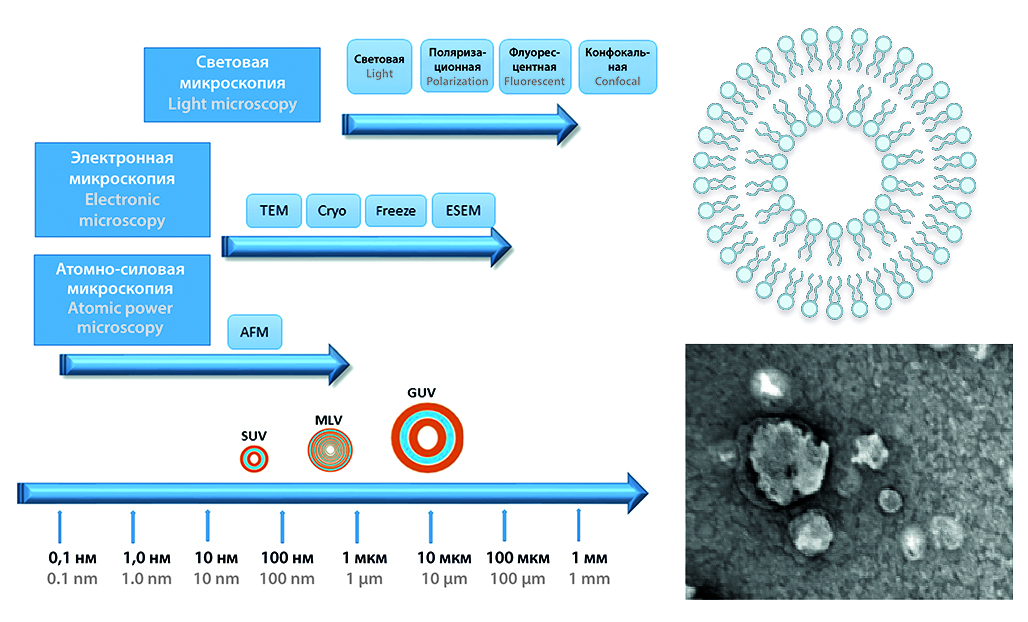
Текст. Существует широкий спектр методов визуализации, доступных для оценки морфологии липосом и их качества, каждый из которых имеет свои преимущества и недостатки: световая микроскопия, ESEM, TEM, AFM и пр. В целом выбор метода зависит от того, какие морфологические характеристики и степень детализации требуются. В процессе подготовки проб липосом важно понимать особенности образцов и метода визуализации. Адекватно проведенные исследования по фармакокинетике и биораспределению также могут расцениваться как инструмент визуализации липосом. Фармакокинетика липосомальных форм определяется множеством факторов, таких как природа ЛС, дозировка, липидный состав, размер липосом, заряд, покрытие липосом вспомогательными веществами и способ введения. Кроме того, взаимодействие липосомальных форм с иммунной системой, ретикулоэндотелиальной системой и компонентами крови играет важную роль в их абсорбции, распределении и выведении из организма.
Заключение. Лучшее понимание абсорбции, биораспределения, метаболизма и выведения липосомальных форм необходимо для разработки современных лекарственных средств.
Введение. Создание твердых лекарственных форм из гигроскопичных субстанций является сложной технологической задачей. Введение гигроскопичных веществ в полимерную матрицу позволяет снизить их влагосорбционную способность.
Цель. Оценить пригодность термопластичных полимеров для создания твердых дисперсий с расплывающейся субстанцией с целью снижения гигроскопичности субстанции и получения твердых дозированных лекарственных форм с замедленными высвобождением.
Материалы и методы. Субстанция: бис{2-[(2Z)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандионат (ДЭАЭ); вспомогательные вещества: Kollidon® VA 64, Soluplus®, полиэтиленгликоль марок 1500, 6000, 8000, полоксамеры Kolliphor® P 188 и Kolliphor® P 407; реактивы: хлористоводородная кислота, натрия дигидрофосфат, калия гидрофосфат. Расплав компонентов получали на двухшнековом лабораторном экструдере и отливали в силиконовые формы. Полученные твердые лекарственные формы исследовали по показателю «распадаемость» в трех средах, соответствующих отделам ЖКТ человека.
Результаты и обсуждение. Субстанция ДЭАЭ характеризуется как расплывающаяся. Введение ДЭАЭ в полимерные матрицы на основе ПЭГ и его сополимеров позволило снизить гигроскопичность готовых лекарственных форм в виде плиток. Введение в расплав солюбилизаторов позволило получить плитки с надлежащими органолептическими свойствами. Высвобождение ДЭАЭ из плиток в виде медведя или тороида происходит в среднем на 29–47 % быстрее, чем из плиток в виде сердца.
Заключение. Перспективными для дальнейшей разработки плиток, содержащих ДЭАЭ, оказались составы на основе Soluplus® и Kolliphor® P 407. С целью создания плиток с замедленным высвобождением рекомендуется использовать формы в виде сердечек, так как у них меньше площадь поверхности.
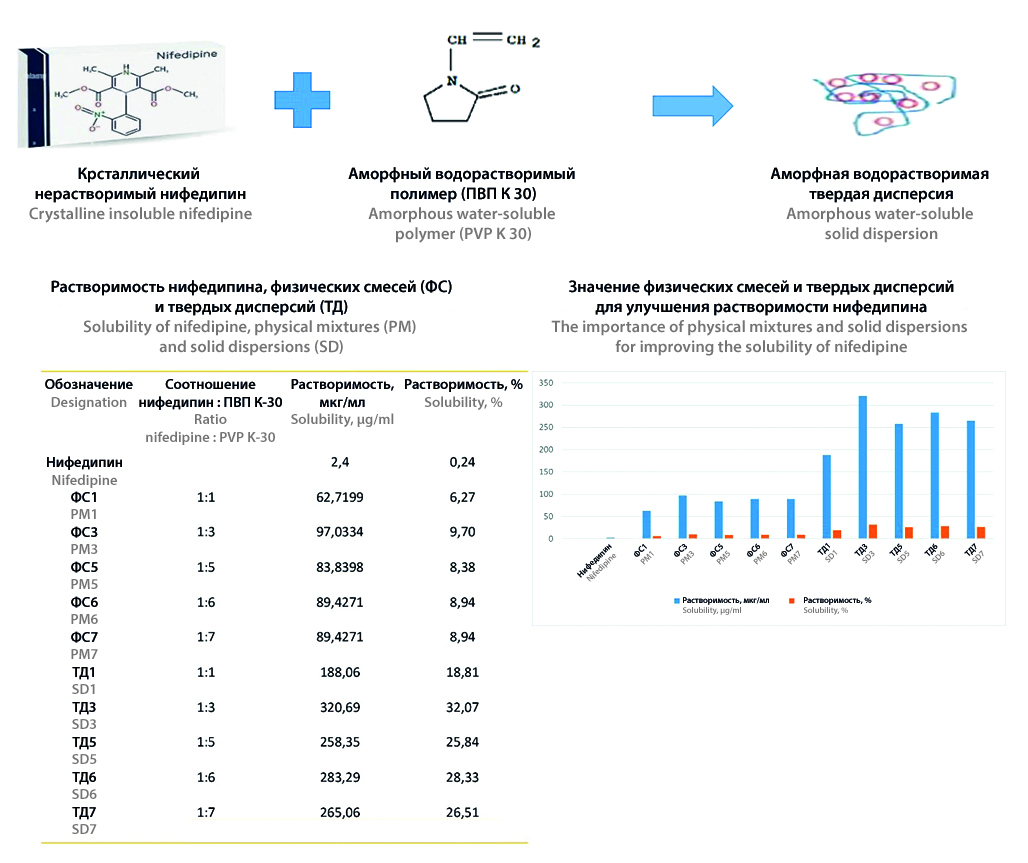
Введение. Низкая растворимость лекарственных веществ в воде часто ограничивает биодоступность лекарственных препаратов при пероральном приеме. Нифедипин, широко применяемый в терапии сердечно-сосудистых заболеваний, принадлежит к группе очень малорастворимых веществ в соответствии с фармакопеями. Поэтому одной из задач разработки состава и технологии лекарственного средства с нифедипином является разработка методики повышения его растворимости. В данном исследовании изучается применение технологии твердых дисперсий (ТД) и физических смесей (ФС) с целью повышения растворимости нифедипина.
Цель. Разработка технологической методики повышения растворимости нифедипина путем разработки ФС и ТД с целью создания лекарственной формы с улучшенными свойствами.
Материалы и методы. В исследовании использовались нифедипин, метанол, стандартные образцы нифедипина, дигидрофосфат калия, гептансульфонат натрия, ортофосфорная кислота (85 %), вода очищенная и поливинилпирролидон К-30. Исследования растворимости проводились методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием трех объектов: нифедипина, физической смеси и ТД нифедипина с ПВП K-30. В исследовании оценивалось влияние различных соотношений (нифедипин : ПВП K-30) в ФС и ТД на растворимость нифедипина. Для характеристики образцов применялись методы инфракрасной спектроскопии с преобразованием Фурье (ИК-фурье-спектроскопия) и рентгеновской дифрактометрии.
Результаты и обсуждение. Полученные результаты свидетельствуют о повышении растворимости нифедипина в физической смеси с ПВП К30 (ФС3) в соотношении 1 : 3, которая составила 9,70 %. В ТД3 с ПВП К30 при соотношении 1 : 3 растворимость увеличивалась до 32,07 % по сравнению с этим показателем для субстанции нифедипина (0,24 %). Анализ инфракрасной спектроскопии не выявил значимых взаимодействий между нифедипином и ПВП K30. Повышение растворимости обусловлено комбинированным эффектом солюбилизирующих свойств носителя и перехода нифедипина из кристаллической формы в аморфную в гидрофильной матрице ПВП К30, что подтверждается результатами рентгеновской дифрактометрии (PXRD).
Заключение. Результаты исследования демонстрируют значительный потенциал технологии ТД для повышения растворимости и биодоступности малорастворимых лекарственных веществ, таких как нифедипин (в 134 раза в ТД3 при соотношении нифедипина и ПВП K-30 1 : 3). Полученные данные подтверждают эффективность данного подхода и открывают новые перспективы для разработки инновационных лекарственных форм с улучшенными фармакокинетическими свойствами на основе ТД нифедипина.
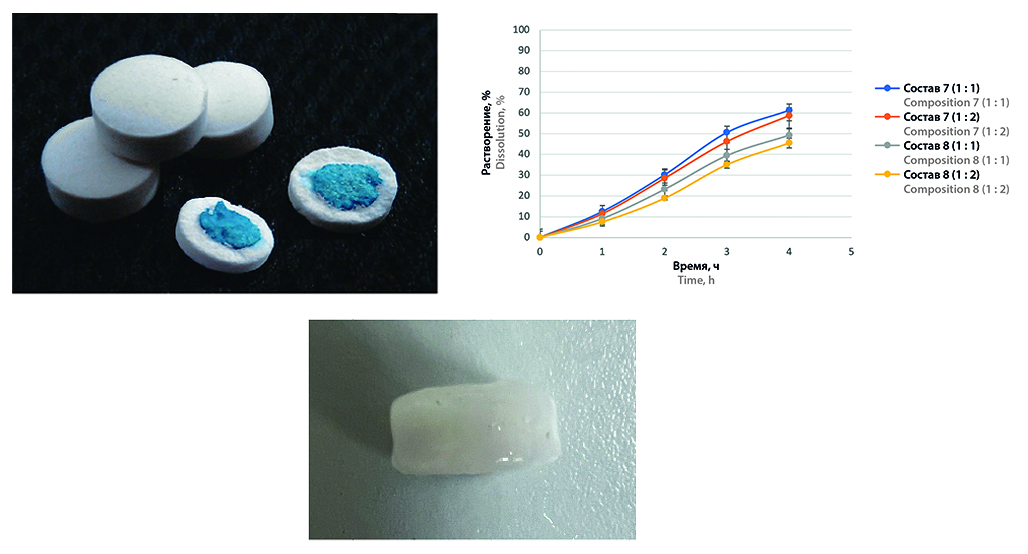
Введение. Разработка универсальных подходов к работе с гигроскопичными субстанциями является актуальной задачей фармацевтической технологии. Особого внимания заслуживает нанесение покрытий на таблетки с гигроскопичными субстанциями. Напрессованные покрытия представляют собой перспективный способ нанесения оболочек на таблетки гигроскопичных субстанций. Такое покрытие может способствовать как приданию заданных характеристик высвобождения действующего вещества в таблетке, так и защите его от факторов окружающей среды, а также может быть альтернативой получению матриксных таблеток пролонгированного действия с гигроскопичными субстанциями в тех случаях, когда прямой контакт АФС с полимерным носителем нежелателен.
Цель. Изучение возможности применения напрессованных покрытий для управления кинетикой высвобождения гигроскопичных субстанций из таблеток на примере ДЭАЭ.
Материалы и методы. Объектом настоящего исследования являлась субстанция бис{2-[(2Z)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандионат (ДЭАЭ), шеллак (BonuLac®, Biogrund GmbH, Германия); сополимер метакриловой кислоты и этилакрилата (AquaPolish® 712, Biogrund GmbH, Германия); сополимер поливинилпирролидона и поливинилацетата (Kollidon® SR, BASF, Германия), этилцеллюлоза (Acros Organics, США). В качестве наполнителя в составы добавляли лактозы моногидрат (Tablettose® 80, Meggle AG, Германия). Для улучшения распадаемости использовали супердезинтегрант кросповидон XL, а также лубрикант стеарилфумарат натрия (JRS, Германия).
Результаты и обсуждение. Изучены свойства напрессованных покрытий. Смесь для покрытия на основе шеллака может быть пригодна для получения кишечнорастворимого покрытия для растворения в среде с рН 4,5. Сополимер ПВП и ПВА не обеспечивает устойчивости покрытий в кислой среде, однако его введение в составы с этилцеллюлозой, а также в составы с сополимером метакриловой кислоты и этилакрилата позволяет добиться равномерного высвобождения во всех средах в течение 5 часов.
Заключение. Проведенное исследование показало возможность применения напрессованных покрытий для управления кинетикой высвобождения АФС. Покрытие, полученное при помощи такой технологии, может быть использовано для гигроскопичных субстанций. Данный метод является полезной альтернативой в случае необходимости разделения матрицеобразующего полимера и АФС, обладающих синергетическими гигроскопичными свойствами.
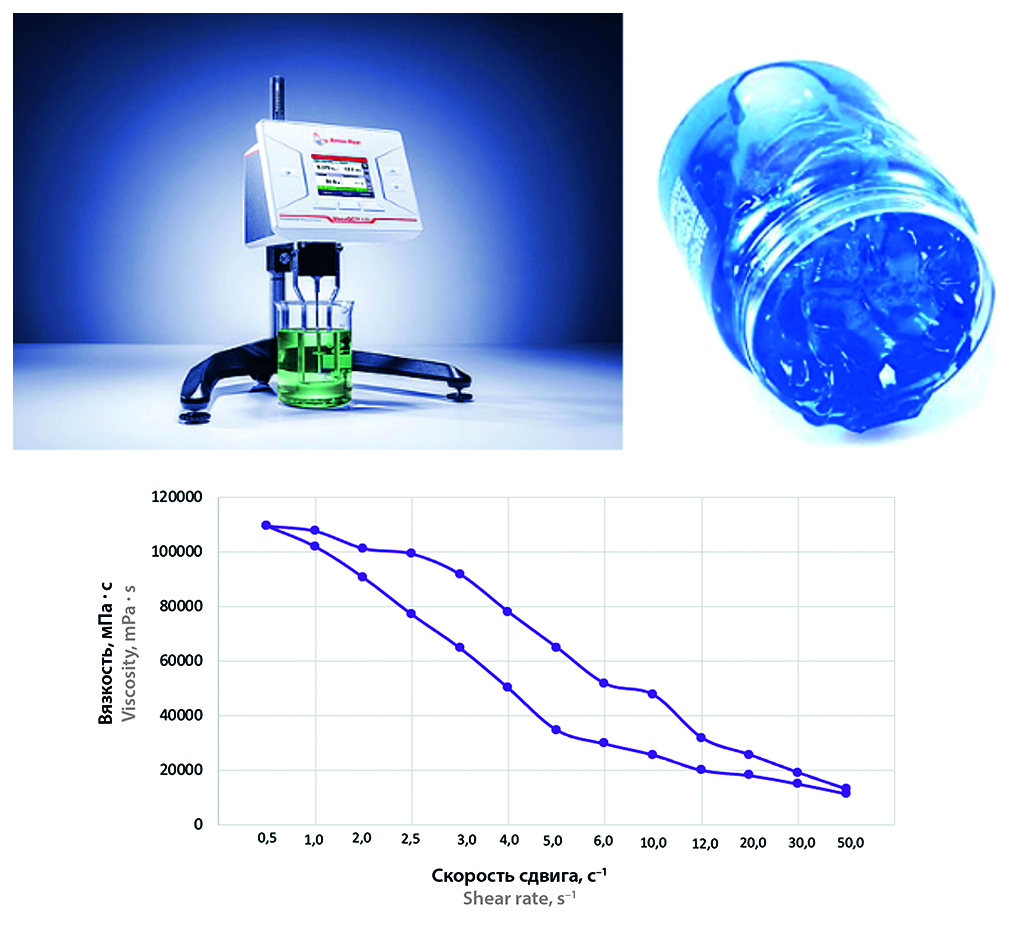
Введение. Разработка антибактериальных препаратов широкого спектра действия для лечения бактериальных и грибковых инфекций кожи животных является актуальной задачей фармацевтической промышленности, медицины и сельскохозяйственной промышленности. Наиболее перспективной лекарственной формой для лечения поверхностных инфекционных заболеваний является гель. Наиболее важными преимуществами являются отсутствие побочных эффектов, связанных с приемом внутрь, а также образование защитной пленки, препятствующей повторному инфицированию животного.
Цель. Разработка состава топической формы в виде геля на основе активной фармацевтической субстанции, обладающей широким спектром антимикробного действия, для терапии инфекционных заболеваний кожных покровов животных.
Материалы и методы. Объектом исследования являлась оригинальная субстанция – производное тиадиазола, полученное отделом органического синтеза кафедры органической химии ФГБОУ ВО СПХФУ Минздрава России. В работе были использованы гелеобразователи (натрия альгинат и карбомер), пропиленгликоль, поверхностно-активные вещества (ПАВ) и пр. Полученные гели тиадиазола изучены по показателям: рН, внешнему виду, термостабильности, коллоидной стабильности, образованию пленки; кроме того, определены реологические свойства гелей.
Результаты и обсуждение. Установлено, что гели, в которых в качестве гелеобразователей выступали одновременно альгинат натрия и карбомер, обладали тиксотропными свойствами, обеспечивающими наилучшую стабильность структуры. Гели, в состав которых был добавлен глицерин, образовывали упругую пленку, препятствующую повреждению и высыханию кожного покрова животного.
Заключение. В результате проведенного исследования был разработан состав топической формы в виде геля, содержащего новое производное тиадиазола, предназначенное для лечения инфекционных заболеваний кожных покровов животных.
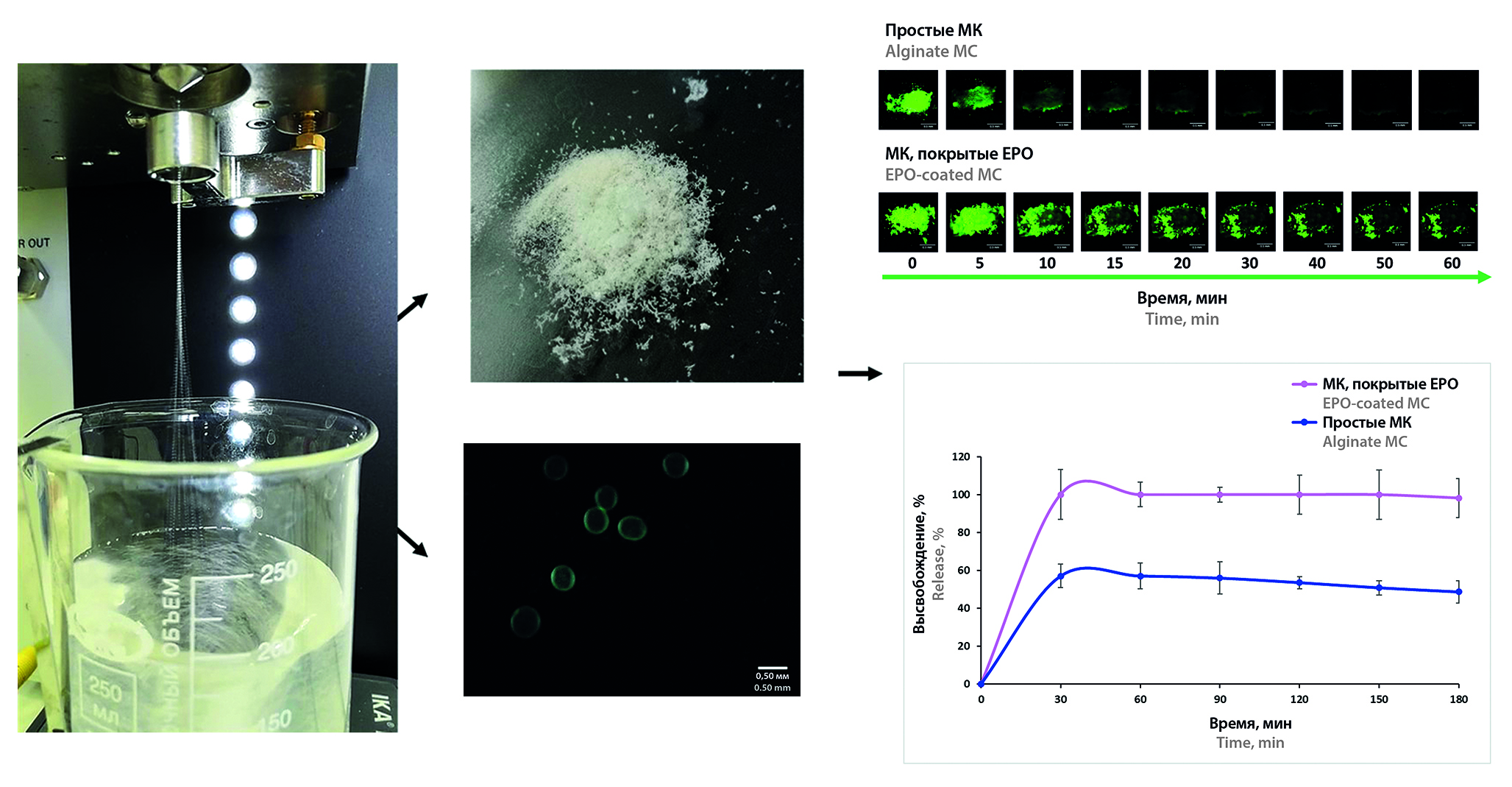
Введение. Микроразмерные частицы представляют большой интерес для применения в различных системах доставки лекарств. Особое место занимает интраназальный способ введения благодаря ряду преимуществ, включая простоту применения, минимальные побочные эффекты и возможность быстрой доставки лекарственных веществ (ЛВ) непосредственно в мозг. Лекарство в составе микрочастиц действует локально, обеспечивая тем самым выход ЛВ в нужном количестве в органе-мишени. ЛВ из носа поступает напрямую в головной мозг через обонятельную область по чувствительным нервам. Разработка микроразмерных частиц, обладающих способностью к мукоадгезии на поверхности носовой слизистой, позволит увеличить биодоступность (БД) лекарств, применяемых в терапии заболеваний и нарушений центральной нервной системы (ЦНС).
Цель. Разработка и исследование микрокапсул, обладающих мукоадгезивными свойствами, для их использования в системе интраназальной доставки леводопы.
Материалы и методы. Микрокапсулы (МК) получали методом ультразвукового электрораспыления на инкапсуляторе B-390 (BUCHI, Швейцария) с последующей фильтрацией под вакуумом, промывкой деионизированной водой и высушиванием лиофильно при –50 °С и 0,05 мБар в течение 48 ч в сушилке FreeZone 1 L (Labconco, США). Изучение структурных особенностей МК проводилось методом оптической микроскопии с применением прямого микроскопа Evident CX33 с цифровой камерой высокого разрешения (Olympus, Япония). Для обработки изображений использовали программное обеспечение ImageView™. Оценку морфологии МК также проводили с применением портативного источника ультрафиолетового света (Jialitte F114, Китай) при помощи цифрового USB-микроскопа (OT-INL40 1000X, Китай). Исследование мукоадгезивных свойств МК, загруженных флуоресцеинатом натрия, проводилось с применением изолированной слизистой носа овцы в инкубаторе SI60 (Stuart, Великобритания) при температуре 37,0 ± 0,5 °С. Получение флуоресцентных изображений осуществлялось с применением системы визуализации высокого разрешения TLC Visualizer 3 (CAMAG®, Швейцария). Программное обеспечение ImageJ 1.53e (ImageJ, США) использовали для обработки полученных макроскопических изображений и построения графиков. Оценка эффективности инкапсуляции, % (ЭИ%), и загрузочной емкости, % (ЕЗ%), МК леводопой проводилась УФ-спектрофотометрически на приборе Evolution™ 220 (Thermo Fisher Scientific, США) при длине волны 202 нм. Высвобождение леводопы из МК выполнялось на приборе «Проточная ячейка» CE 7smart (SOTAX AG, Швейцария), метод IV (Государственная фармакопея РФ XV издания, ГФ РФ XV), при температуре 37 ± 0,5 °С в течение 3 ч в среде искусственной назальной жидкости (ИНЖ). Количество высвобождавшегося ЛВ определялось на УФ-спектрофотометре Evolution™ 220 (Thermo Fisher Scientific, США) при длине волны 202 нм.
Результаты и обсуждение. Разработана методика получения МК, подобраны параметры прибора и оптимальный состав микрочастиц. Было получено 2 типа МК: простые МК на основе альгината натрия и МК, покрытые Eudragit® ЕРО (ЕРО), обладающие мукоадгезивными свойствами. Средний диаметр простых МК составил 0,365 ± 0,018 мм, МК, покрытых ЕРО, – 0,426 ± 0,017 мм. Простые МК смываются с поверхности изолированной слизистой носа овцы через 5 мин после орошения ИНЖ, а МК, покрытые ЕРО, удерживаются в течение 1 ч. ЭИ% МК леводопой выше 90 %. ЕЗ% МК, покрытых ЕРО, больше, чем у простых МК. Выход леводопы в среду ИНЖ из МК, покрытых ЕРО, составил 100 % уже через 30 мин исследования, у простых МК – не более 60 ± 6,1 % через 3 ч.
Заключение. МК, покрытые ЕРО, обладают мукоадгезивными свойствами на поверхности слизистой носа, и их дальнейшее исследование является перспективным с целью применения в системах интраназальной доставки леводопы.
МЕТОДЫ АНАЛИЗА ЛЕКАРСТВЕННЫХ СРЕДСТВ
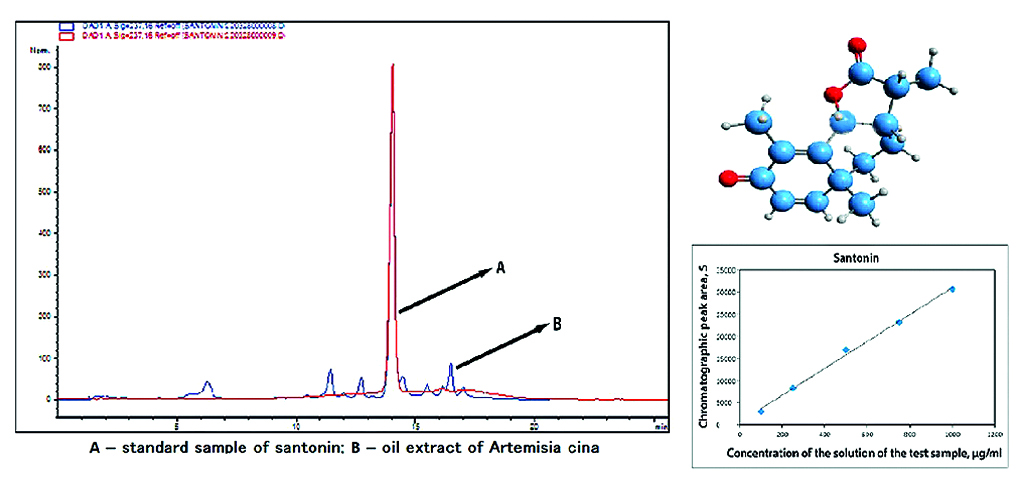
Введение. Проблема разработки и внедрения отечественных препаратов в Казахстане на сегодняшний день является острой и актуальной. Решение данной проблемы возможно посредством использования собственных ресурсов – отечественного лекарственного растительного сырья. Перспективным лекарственным сырьем является полынь цитварная – эндемичное лекарственное растение Туркестанской области Казахстана.
Цель. Разработка методики жидкостной хроматографии для анализа масляного экстракта полыни цитварной.
Материалы и методы. Стандартный образец (СО) сантонина масляный экстракт полыни цитварной (МЭПЦ). Идентификацию и количественное определение вещества проводили на жидкостном хроматографе Agilent Technologies 1200 (США) с программным обеспечением ChemStation.
Результаты и обсуждение. Исследование хроматографического поведения основного действующего вещества масляного экстракта проводилось методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Подбор условий разделения на колонке включает в себя выбор оптимального состава подвижной фазы и скорости элюирования. Использовалась обращенно-фазовая система с сорбентом C18 и подвижной фазой, состоящей из ацетонитрила и фосфатного буфера с рН 6,8. Хроматографические исследования субстанции проводили в градиентном режиме при аналитической длине волны 237 нм. Время удерживания стандартного образца (СО) сантонина совпало со временем удерживания (tR) сантонина выделенного из масляного экстракта полыни цитварной и составило 14,3 мин.
Заключение. Разработана методика идентификации и количественного определения масляного экстракта по основному действующему веществу – сантонина методом жидкостной хроматографии.
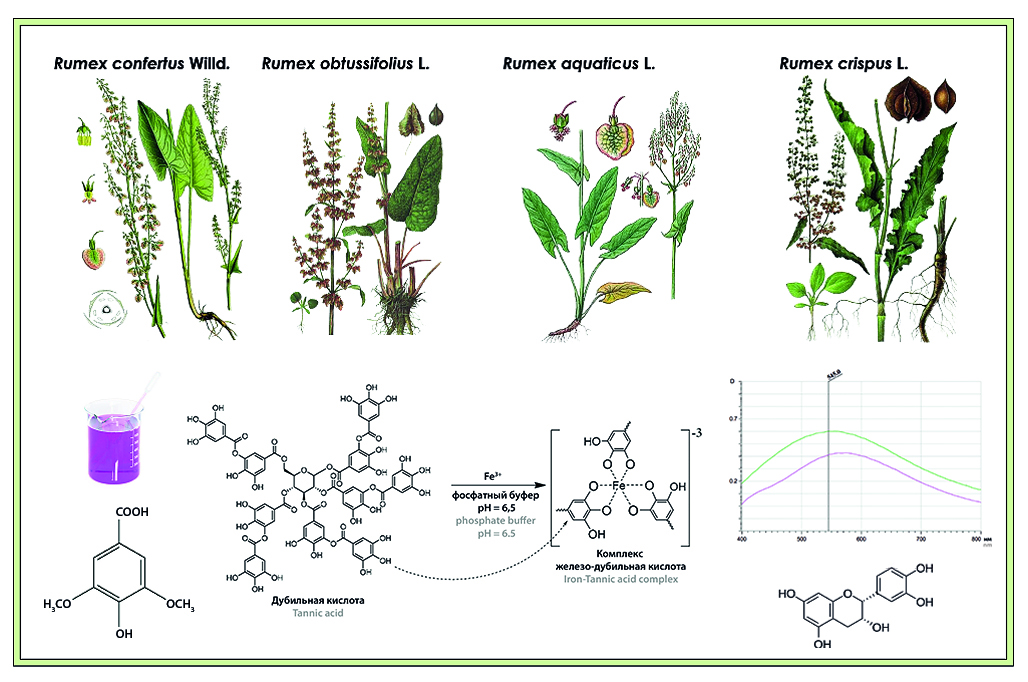
Введение. Изучение химического состава лекарственного растительного сырья и сравнительный анализ динамики накопления биологически активных веществ в родственных лекарственных растениях необходимы для создания высокоэффективных и безопасных лекарственных средств. Сходным с официнальным представителем рода Rumex (далее R.) – R. confertus – метаболомом обладают широко распространенные в России виды: шавель курчавый, шавель туполистный, шавель водный, что обуславливает перспективность изучения данных видов. Научный и практический интерес представляет изучение обладающей антибактериальной активностью группы БАВ – дубильных веществ на различных фенологических стадиях развития растения.
Цель. Количественное определение дубильных веществ методами перманганатометрии и спектрофотометрии в подземных органах шавеля конского, щ. курчавого, щ. водного, щ. туполистного, заготовленных в различные фазы вегетации: отрастания, цветения и отмирания надземной части.
Материалы и методы. Анализировались водные извлечения из подземных органов изучаемых видов щавеля. Извлечения и полученные в ходе исследования растворы анализировались с помощью методов перманганатометрии, спектрофотометрии и ВЭЖХ. Соединения из группы дубильных веществ идентифицировали по длине волны максимума поглощения.
Результаты и обсуждение. Проведена оценка количественного содержания дубильных веществ методами перманганатометрии, спектрофотометрии и ВЭЖХ.
Заключение. В извлечениях из подземных органов щ. конского, щ. курчавого, щ. туполистного, щ. водного были обнаружены и количественно определены дубильные вещества, проанализирована зависимость между их количественным содержанием и фазой вегетации.
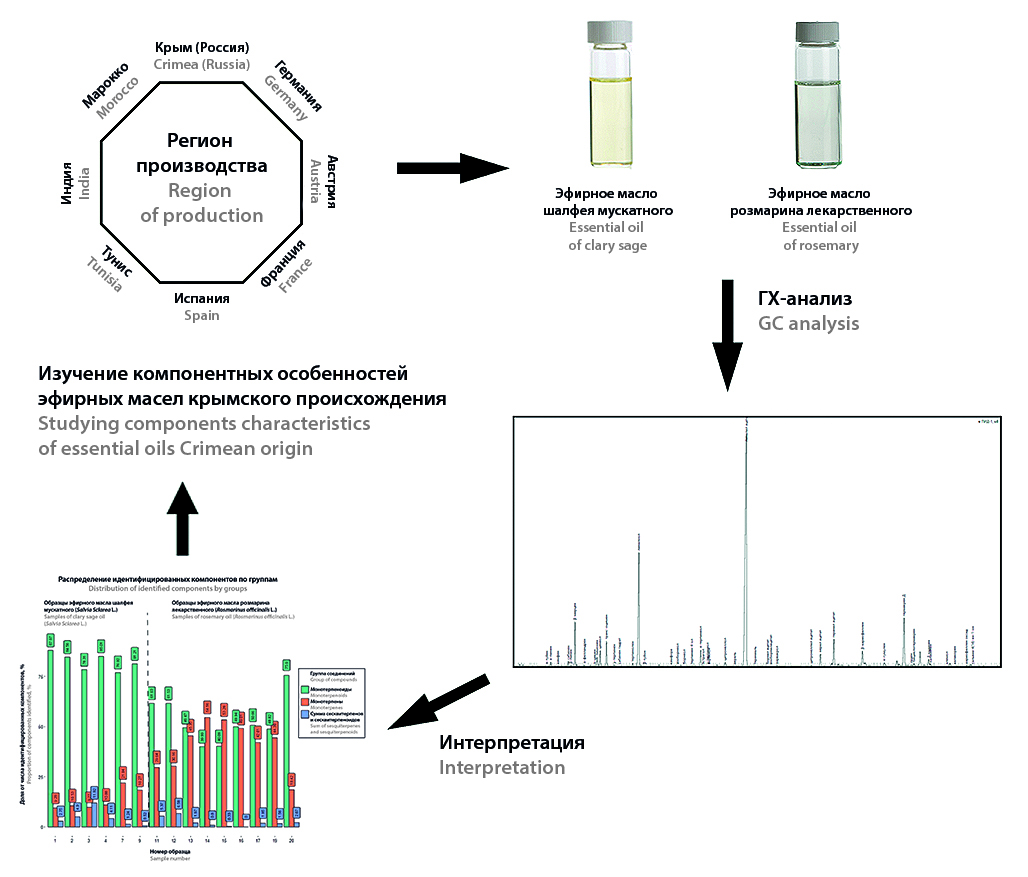
Введение. Хроматографическое профилирование является наиболее эффективным способом установления подлинности эфирных масел, ключевым ограничением которого является число разработанных хроматографических профилей. Методология профилирования позволяет учесть географическую вариабельность эфирных масел путем дифференцирования профиля на зоны произрастания эфиромасличного сырья. Несмотря на наличие разработанных хроматографических профилей, на текущий момент отсутствуют сведения о возможной географической вариабельности востребованных эфирных масел шалфея мускатного и розмарина лекарственного, полученных из отечественного эфиромасличного сырья.
Цель. Сравнительное исследование компонентного состава эфирных масел шалфея мускатного и розмарина лекарственного, произведенных из сырья российского и зарубежного происхождения, для характеризации отечественных эфирных масел.
Материалы и методы. Анализ эфирных масел выполнен на программно-аппаратном комплексе газового хроматографа «Кристалл 5000.2» с пламенно-ионизационным детектированием. Разделение проводилось на капиллярной колонке HP-5MS UI и на капиллярной колонке DB-WAX. Идентификация компонентов проводилась путем сравнения расчетных линейных индексов удерживания, полученных на двух колонках различной полярности, со справочными значениями.
Результаты и обсуждение. В ходе проведенного анализа эфирных масел шалфея мускатного и розмарина лекарственного было идентифицировано 42 и 33 соединения, в среднем представляющих 93,7 и 96,2 % от всех компонентов пробы соответственно. Для образцов шалфея мускатного крымского происхождения отмечен ряд закономерностей, потенциально пригодных для обособления его компонентного состава от эфирных масел иного происхождения. На основании изучения компонентного состава эфирного масла розмарина лекарственного крымского происхождения выдвинуто предположение о его отнесении к эфирному маслу розмарина испанского типа в соответствии с ISO и Ph. Eur.
Заключение. Результаты исследования позволили выдвинуть ряд предположений относительно возможности выделения специфического хроматографического профиля эфирных масел шалфея мускатного и розмарина лекарственного крымского происхождения. Дальнейшая экспериментальная проверка выдвинутых предположений позволит определить возможность введения четких классификационных критериев для масел крымского происхождения.
Введение. Жидкие лекарственные формы на основе лекарственного растительного сырья удобны в применении и должны удовлетворять требованиям безопасности. В рамках гармонизации фармакопейных требований определения суммарного содержания тяжелых металлов в настойках недостаточно. Необходима оценка рисков для вычисления допустимых концентраций содержания тяжелых металлов в настойках.
Цель. Оценить безопасность использования настоек с точки зрения содержания тяжелых металлов и мышьяка в рамках риск-ориентированной стратегии.
Материалы и методы. Объектами исследования были 20 образцов настоек валерианы и пустырника промышленного производства разных предприятий. Количественное содержание 15 элементов (As, Cd, Co, Cr, Cu, Fe, Hg, Mn, Mo, Ni, Pb, Sr, Tl, V, Zn) определяли методом масс-спектрометрии с индуктивно связанной плазмой.
Результаты и обсуждение. Концентрации элементов в настойках варьировали в диапазоне 0–1,84 мкг/г. В максимальных количествах найдены марганец и цинк, в минимальных – кадмий, молибден и ванадий. Ртуть не обнаружена во всех образцах. Содержание токсичных элементов в настойках не превышало уровней допустимых концентраций, регламентированных нормативной документацией Российской Федерации. Определены суммарные индексы опасности (HI), рассчитанные на уровнях медианы и 90-го процентиля содержания элементных токсикантов. В настойках они составили соответственно: валерианы – 0,016 · 10–5 и 0,027 · 10–5, пустырника – 0,022 · 10–5 и 0,028 · 10–5. Полученные значения были значительно ниже 1,0. Расчет индивидуального канцерогенного риска (CR) элементных канцерогенов (Cd, As, Cr, Pb), поступающих в организм с настойками валерианы и пустырника, показал, что величины CR находились в диапазоне 4,9 · 10–9–6,84 · 10–7, что не превышало допустимого порогового значения (1 · 10–6).
Заключение. Фактическое содержание токсичных элементов (Pb, Cd, As, Hg) в настойках валерианы и пустырника (0–0,006 мкг/г) не превышало уровней допустимых концентраций. Расчеты неканцерогенных рисков при использовании настоек валерианы и пустырника показали, что суммарное воздействие 15 изученных элементов на здоровье человека при потреблении суточной дозы настоек характеризуется как допустимое, проводить периодический мониторинг содержания ненормируемых элементов в образцах лекарственных растительных препаратов не требуется. Установлено, что изученные настойки валерианы и пустырника не являются онкогенными факторами и не требуют мероприятий по снижению риска при их использовании.
ДОКЛИНИЧЕСКИЕ И КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
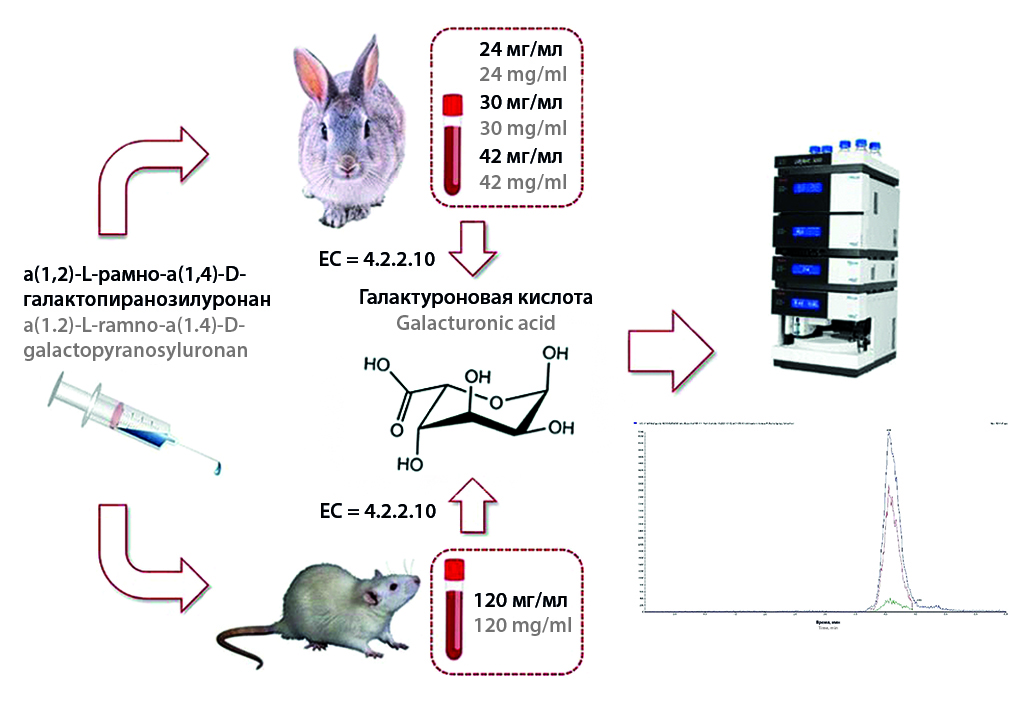
Введение. α(1,2)-L-рамно-α(1,4)-D-галактопиранозилуронан – водорастворимый гетерополисахарид, выделенный из корневищ аира болотного (Acorus calamus L.) и обладающий противоопухолевым, антиметастатическим, иммуномодулирующим и гепатопротекторным действием, защитным действием на угнетенное в ходе цитостатического лечения кроветворение.
Цель. Валидация биоаналитической методики определения α(1,2)-L-рамно-α(1,4)-D-галактопиранозилуронана Acorus calamus L. и изучение фармакокинетических параметров нового лекарственного средства на его основе после однократного введения 120 мг/кг крысам и 24, 30, 42 мг/кг кроликам.
Материалы и методы. В исследовании использованы в качестве основных животных 8 крыс-самцов (средняя масса – 300 г). В качестве второго вида животных использовали 6 кроликов-самцов (средняя масса тела – 2,5 кг). Эксперимент по оценке доз проведен на 24 кроликах (масса тела – 2,3–2,5 кг) Количественное определение α(1,2)-L-рамно-α(1,4)-D-галактопиранозилуронана Acorus calamus L. в плазме крови животных проводили методом ВЭЖХ-МС/МС, аналитическая форма – галактуроновая кислота. Методика пробоподготовки биообразцов включала стадию ферментативного гидролиза α(1,2)-L-рамно-α(1,4)-D-галактопиранозилуронана Acorus calamus L. раствором пектиназы до образования галактуроновой кислоты.
Результаты и обсуждения. Изучена фармакокинетика нового лекарственного средства α(1,2)-L-рамно-α(1,4)-D-галактопиранозилуронана Acorus calamus L. после однократного введения доз 120 мг/кг крысам и 24, 30, 42 мг/кг кроликам. Среднее время пребывания лекарственного средства в организме кролика составило 1,0 ± 0,21 ч, время полувыведения – 0,7 ± 0,15 ч. Среднее время пребывания лекарственного средства в организме крысы составило 1,16 ч, время полувыведения T1/2 – 0,80 ч. После однократного внутривенного введения кроликам 24, 30 и 42 мг/кг максимальная концентрация в системном кровотоке достигается через 5 мин после введения и составляет в среднем 133,95 ± 27,04, 145,86 ± 40,90 и 226,13 ± 41,27 мкг/мл соответственно, период полураспределения варьировался от 0,22 до 0,26 ч, период полувыведения – от 3,52 до 3,96 ч.
Заключение. Проведена оценка фармакокинетических параметров α(1,2)-L-рамно-α(1,4)-D-галактопиранозилуронана Acorus calamus L. на животных, основанная на использовании методики количественного определения галактуроновой кислоты методом ВЭЖХ-МС/МС.
Введение. Сахарный диабет 2 типа (СД2) входит в число наиболее распространенных заболеваний и основных причин смертности среди населения развитых стран. Это серьезная проблема общественного здравоохранения, и значимость ее растет: согласно оценкам, к 2025 году количество пациентов, страдающих этим заболеванием, превысит 380 миллионов.
Цель. Оценка влияния кетогенных диет на гликемический контроль пациентов с СД 2 типа в провинциях Киркук и Мосул.
Материалы и методы. С 01.09.2022 г. по 01.04.2023 г. в городах Мосул и Киркук проводилось исследование с целью оценки влияния кетогенной диеты (кетодиеты) на изменение уровня HbA1c и липидного профиля у пациентов с СД2.
Результаты и обсуждение. Исследование выявило следующее распределение пациентов по полу и возрасту: пациенты женского пола составили 46,3 %, мужского – 56,7 % от общего количества пациентов, при этом доля пациентов в возрасте старше 56 лет составила 30 % среди женщин и 60,7 % среди мужчин. Р-значение в оценке изменений уровня HbA1C до и после применения кетодиеты оказалось существенным (0.0001), так же как и в оценке изменений липидного профиля до и после проведения кетодиеты (0.001); в отношении общего уровня глицеридов p-значение также было существенным и достигало величины 0.002. Принимая во внимание большие размеры частиц ЛПНП, нами была выдвинута гипотеза о том, что возникновение кардиоваскулярных проблем вследствие повышения уровня ХС ЛПНП маловероятно. Для людей с диабетом второго типа кетогенная диета с очень низким содержанием углеводов (VLCKD) (менее 50 г в день) является безопасным, легко переносимым и широко признанным видом диетотерапии, помогающим изменить образ жизни и поведенческие привычки в течение четырех месяцев при применении в сочетании с интервенционной программой по снижению веса.
Заключение. Прослеживается хорошо заметная связь между кетогенной диетой и такими показателями больных сахарным диабетом, как уровень HbA1c и липидный профиль. Предполагается проведение дальнейших исследований с увеличением числа пациентов и продолжительности наблюдения.
Введение. При проведении терапевтического лекарственного мониторинга (ТЛМ) часто возникает ситуация, когда концентрацию лекарственного средства измеряют разными методами или в разных лабораториях. Для объединения и анализа данных, полученных с помощью разных методов, необходимо выполнять перекрестную валидацию (кросс-валидацию). Применяемым для этого статистическим подходам уделяется недостаточное внимание.
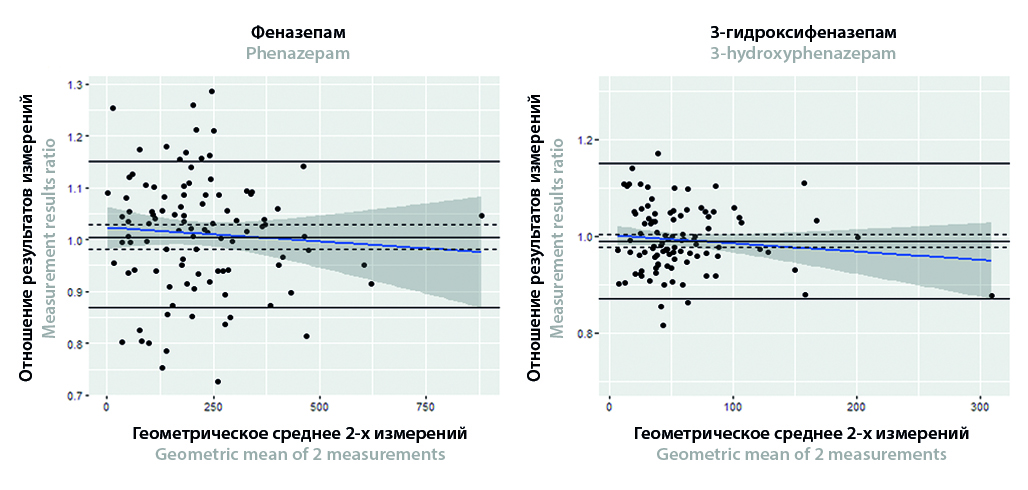
Цель. Выполнить кросс-валидацию разных методик количественного определения феназепама (ФЕН) и 3-гидроксифеназепама (3-ОН-ФЕН) с помощью анализа Бленда – Альтмана.
Материалы и методы. Концентрации ФЕН и 3-ОН-ФЕН в плазме крови пациентов (n = 100) c синдромом отмены алкоголя были измерены с помощью высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией (ВЭЖХ-МС/МС). В каждом образце содержание обоих аналитов измеряли двукратно с помощью двух разных методик: твердофазной экстракции (SPE, от англ. «solid phase extraction») и жидкостной экстракции с поддержкой (SLE, от англ. «supported liquid extraction»). Обе методики до начала эксперимента прошли полную валидацию. Кросс-валидация проводилась по завершении эксперимента с использованием данных от испытуемых образцов. Для оценки правильности (accuracy) и прецизионности (precision) использовали анализ Бленда – Альтмана. Для выявления систематической ошибки между методиками также применяли регрессионный анализ Деминга.
Результаты и обсуждение. Для обоих аналитов были получены регрессионные зависимости между концентрациями, измеренными разными методами пробоподготовки. 95%-й доверительный интервал (ДИ) коэффициентов обоих уравнений включал единицу, а 95%-й ДИ свободного члена включал ноль. 95%-й ДИ геометрического среднего индивидуальных отношений SLE/SPE находился в пределах допустимого диапазона (0,87; 1,15). Данные результаты подтверждают отсутствие влияния количественной методики на измерение концентрации обоих аналитов. 66,7%-й ДИ относительной погрешности между двумя измерениями находился в допустимых пределах (–0,2; 0,2), не превышая 20%-й диапазон от их среднего значения. Это подтверждает приемлемую прецизионность между методиками. Вычисленные доверительные интервалы отражены на диаграммах аналитического смещения по Бленду – Альтману.
Заключение. Применяемые в работе статистические подходы подтвердили сопоставимость результатов разных методик пробоподготовки. Описанный в работе статистический алгоритм с применением диаграмм аналитического смещения по Бленду – Альтману, помимо кросс-валидации, может успешно применяться для оценки правильности и прецизионности при валидации и оценке приемлемости аналитического цикла, а также при повторном анализе испытуемых образцов.
Введение. Развитие сердечной недостаточности тесно связано с появлением жизнеугрожающих аритмий, которые нередко являются терминальным событием для данных пациентов. Анализ рандомизированных клинических исследований ингибиторов натрий-глюкозного котранспортера 2 типа свидетельствует о клинически значимом потенциале данных препаратов как средств с антиаритмическими свойствами. Однако полный механизм, за счет которого может реализоваться данный эффект, в настоящий момент все еще остается до конца не изученным.
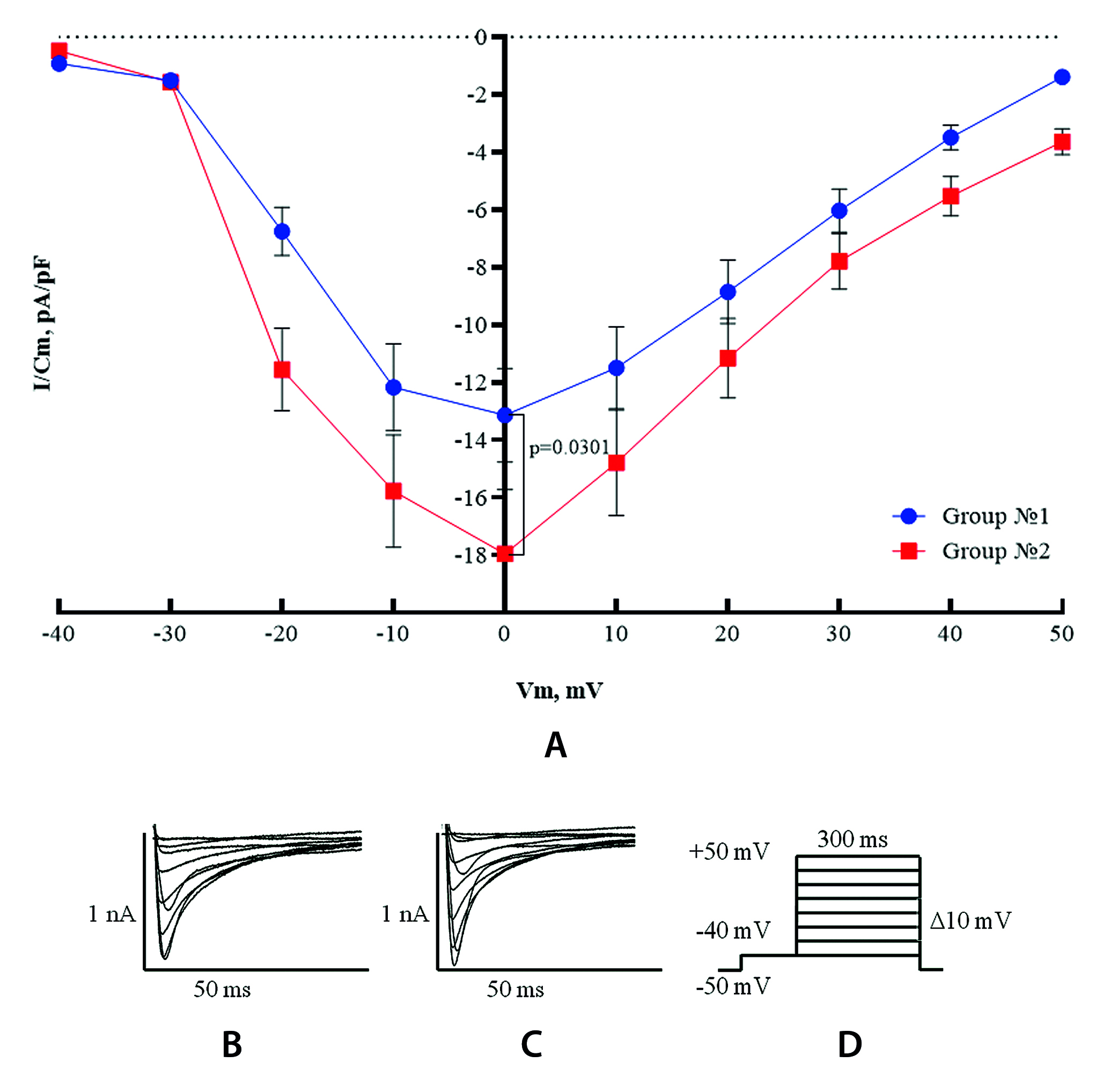
Цель. Оценка влияния эмпаглифлозина на трансмембранные токи кальция и внутриклеточные кальциевые переходные процессы на изолированных желудочковых кардиомиоцитах мышей в условиях нормогликемии.
Материалы и методы. В эксперименте проводили выделение желудочковых кардиомиоцитов от 12 аутбредных мышей самцов. Были сформированы 2 группы: группа № 1 – контрольные желудочковые кардиомиоциты; группа № 2 – желудочковые кардиомиоциты после двух часовой инкубации с 5 µмоль/л раствором эмпаглифлозина. Выполнялись запись трансмембранных токов кальция и оценка внутриклеточных кальциевых переходных процессов.
Результаты и обсуждение. Инкубация желудочковых кардиомиоцитов в присутствии эмпаглифлозина значительно увеличила плотность тока ICa и ускорила временную динамику Ca2+. Амплитуда волны Ca2+ и скорость нарастания и затухания были увеличены, а продолжительность волны была сокращена.
Заключение. Результат эксперимента указывает на то, что эмпаглифлозин способен модулировать Са2+-зависимый механизм электромеханического сопряжения, усиливая и ускоряя выход Са2+ в цитоплазму и обратный его захват. Это предположительно оптимизирует, а именно сокращает время систолы и усиливает ее, что может являться одним из важных элементов проявления антиаритмических свойств эмпаглифлозина.
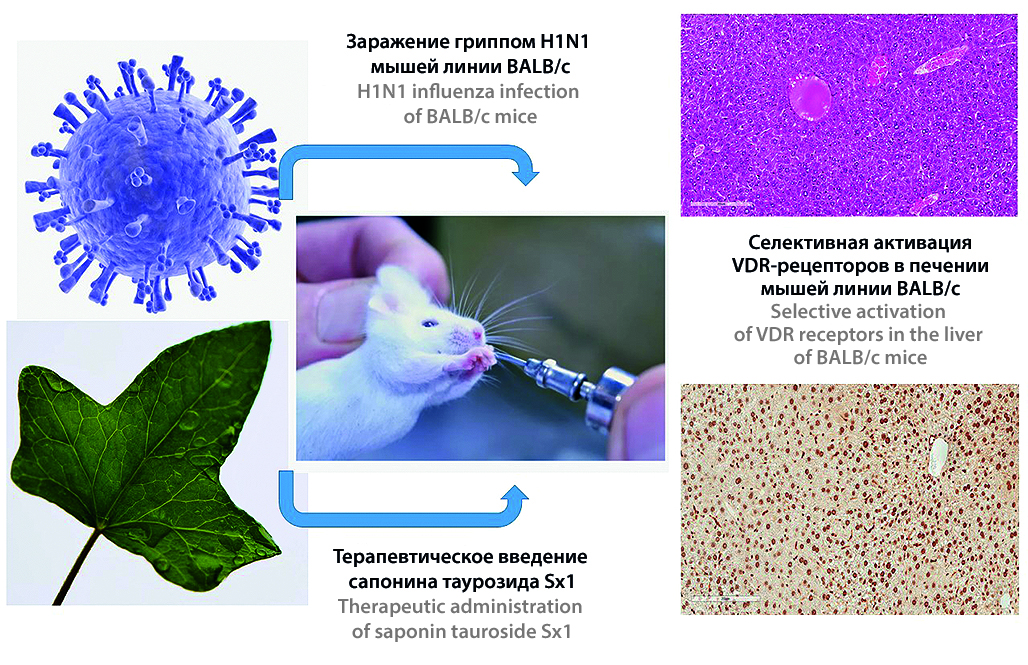
Введение. Развитие гриппозной инфекции нередко сопровождается гепатитом, механизм патогенеза которого до конца не изучен. Согласно литературным данным, дефицит витамина D, участвующего в регуляции иммунного ответа, является одним из факторов риска возникновения ОРВИ. Известно, что некоторые растительные соединения способны взаимодействовать с рецептором витамина D (VDR). Подобными активаторами могут быть сапонины, которые нашли применение в клинической практике благодаря широкому спектру биологической и фармакологической активности, противовирусные механизмы которой являются малоизученными.
Цель. Исследовать влияние перорального введения сапонина таурозида Sx1, полученного из крымского плюща, на продолжительность жизни и активацию рецепторов к витамину D в печени мышей при гриппозной инфекции различной степени тяжести.
Материалы и методы. В эксперименте были использованы 11 подгрупп, сформированных из самцов мышей BALB/c с гриппозной инфекцией различной степени тяжести в зависимости от введения им инфицирующей дозы 5 ЛД50 или 10 ЛД50 вируса, включая контроль. В качестве корректора применяли сапонин таурозид Sx1. Иммуногистохимическое исследование проводили в автоматическом режиме в иммуногистостейнере BOND-MAX (Leica, Германия). Использовали первичные кроличьи поликлональные антитела к рецептору витамина D.
Результаты и обсуждение. На фоне введения таурозида Sx1 в дозе 200 мкг/мышь/сутки на 4,6 дня увеличивается средняя продолжительность жизни животных, получавших сапонин. Снижение инфицирующей дозы вируса гриппа (ВГ) с 10 ЛД50 до 5 ЛД50 также изменило срок начала гибели животных на 2 дня в обеих группах. При различной инфицирующей дозе вируса на 10-й день эксперимента в подгруппах без коррекции изменяется экспрессия рецепторов к витамину D. В подгруппе 2V количество суммарных положительных клеток было ниже, чем в контрольной группе. При этом в подгруппе 2Vir экспрессия VDR была значительно выше группы контроля.
Заключение. Исследуемый сапонин таурозид Sx1 в дозе 200 мкг/мышь/сутки оказывает противовирусный эффект при экспериментальном инфицировании мышей вирусом гриппа A/H1N1, который проявляется увеличением средней продолжительности жизни животных (на 4,6 дня) и уменьшением процента летальности при тяжелой гриппозной инфекции в сравнении с контрольной группой. Введение сапонина на 4-й день эксперимента во всех подгруппах снижает общее количество иммунных клеток, интенсивно экспрессирующих VDR.
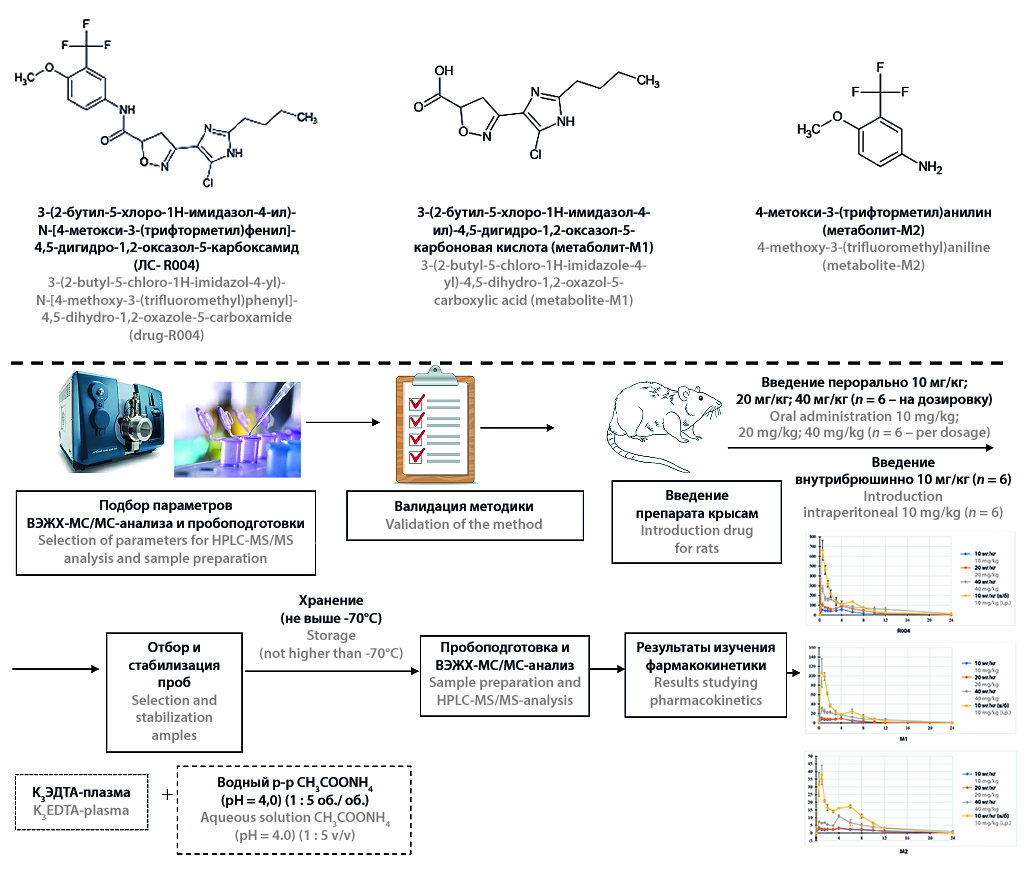
Введение. 3-(2-бутил-5-хлоро-1Н-имидазол-4-ил)-N-[4-метокси-3-(трифторметил)фенил]-4,5-дигидро-1,2-оксазол-5-карбоксамид (R004) является новой перспективной молекулой для терапии ревматоидного артрита. Данное соединение находится на стадии доклинического исследования, в ходе которого вместе с эффективностью и безопасностью необходимо изучить его фармакокинетику. При этом необходимо установить основные фармакокинетические параметры лекарственного средства и его метаболитов в плазме крови при однократном введении.
Цель. Оценка линейности фармакокинетики и относительной биодоступности 3-(2-бутил-5-хлоро-1Н-имидазол-4-ил)-N-[4-метокси-3-(трифторметил)фенил]-4,5-дигидро-1,2-оксазол-5-карбоксамида после однократного введения субстанции крысам.
Материалы и методы. Субстанцию R004 вводили крысам однократно перорально в дозировках 10 мг/кг, 20 мг/кг и 40 мг/кг и внутрибрюшинно в дозировке 10 мг/кг. Исследование проводилось на 24 крысах линии Wistar: по 6 крыс на каждую из дозировок. Образцы крови отбирались до введения и через 30 мин, 1 ч, 1 ч 30 мин, 2 ч, 3 ч, 4 ч, 6 ч, 8 ч, 10 ч, 12 ч, 24 ч после введения лекарственного средства. Полученная плазма стабилизировалась 250 мМ раствором ацетата аммония для предотвращения гидролиза R004. Подготовку проб плазмы осуществляли путем осаждения белков ацетонитрильным раствором внутренних стандартов. Измерение концентрации R004 и его метаболитов 3-(2-бутил-5-хлоро-1Н-имидазол-4-ил)-4,5-дигидро-1,2-оксазол-5-карбоновой кислоты (М1) и 4-метокси-3-(трифторметил)анилина (M2) проводили с помощью ВЭЖХ-МС/МС. При оценке фармакокинетических параметров применялся некомпартментный подход.
Результаты и обсуждение. Разработанная биоаналитическая методика прошла полную валидацию согласно требованиям руководств ЕАЭС по проведению исследований биоэквивалентности и ICH M10. Аналитический диапазон определения в плазме R004 составил 2–2000 нг/мл, М1 и М2 – 1–1000 нг/мл. Зависимость параметров Cmax и AUC0–t изучаемого соединения и его метаболитов от введенной дозы носила линейный характер. Так, величина коэффициента корреляции Cmax R004 составил 0,9995, а параметра AUC0–t – 0,9932. Установлено наличие энтерогепатической рециркуляции R004. Величина относительной биодоступности R004 составила 21,26 %.
Заключение. Разработанная методика успешно применена для фармакокинетического исследования. R004 и его метаболиты обладают линейной фармакокинетикой при пероральном введении субстанции.
Введение. В современном мире все больше внимания уделяется проблеме увеличения случаев микозов. В октябре 2022 года ВОЗ опубликовала первый список патогенных грибов, требующих первоочередного внимания и представляющих наибольшую угрозу для здоровья человека. Среди микотических инфекций одну из лидирующих позиций по частоте занимают различные формы кандидоза. Дрожжи Candida albicans ВОЗ отнесены к группе с критическим приоритетом. Поэтому поиск новых эффективных антимикотических средств является актуальным. В Санкт-Петербургском химико-фармацевтическом университете было синтезировано новое производное 1,3,4-тиадиазола. В опытах in vitro было показано, что оно обладает широким спектром противогрибковой активности, по эффективности сопоставимым с вориконазолом.
Цель. Оценить противогрибковую активность фармацевтической субстанции хлорида 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия (производное тиадиазола, ПТ) на моделях неинвазивного кандидоза кишечника и острой септицемии (сепсиса), вызванных C. albicans.
Материалы и методы. Моделирование неинвазивного кандидоза кишечника проводили путем инфицирования мышей линии BALB/c кандидой при свободном доступе к поилке, содержащей суспензию дрожжевых клеток C. albicans. Предварительно у животных вызывали дисбактериоз раствором антибиотиков (ванкомицин, клиндамицин, гентамицин) в питьевой воде. Моделирование острой септицемии, вызванное C. albicans, проводили путем инфицирования мышей линии BALB/c внутривенным введением взвеси дрожжевой культуры. После заражения мышей им ежедневно однократно внутрижелудочно вводили исследуемую субстанцию и препараты сравнения – вориконазол и флуконазол. В конце эксперимента оценивали количество павших животных и проводили микробиологическое исследование внутренних органов.
Результаты и обсуждение. Было показано, что количество дрожжевых клеток, выделяемых из толстого и тонкого кишечника у мышей с неинвазивным кандидозом кишечника, после введения нового производного тиадиазола во всех испытанных дозах (1, 5, 10 мг/кг) достоверно снижалось по сравнению с контрольной группой № 6 без лечения. В дозе 10 мг/кг испытуемая субстанция проявляла антикандидозное действие на уровне препаратов сравнения, вориконазола и флуконазола. У мышей с септицемией летальность также зависела от дозы производного тиадиазола, но эффективной дозой оказалась только 10 мг/кг.
Заключение. В ходе исследования выявлено, что новое производное тиадиазола хлорид 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия проявляло противогрибковую активность в отношении Candida albicans на модели неинвазивного кандидоза кишечника и модели септицемии (сепсиса). Установлено, что в дозе 10 мг/кг ПТ проявляло активность на уровне препаратов сравнения, вориконазола и флуконазола.
Введение. Этмабен – производное малоновой кислоты с кардиотропной активностью, являющееся перспективным средством для лечения ишемической болезни сердца и хронической сердечной недостаточности. Препарат «Этмабен» находится на фазе I клинических исследований (КИ), ранее его фармакокинетика у человека не изучалась.
Цель. Целью исследования является изучение фармакокинетики препарата «Этмабен, таблетки, покрытые оболочкой, 300 мг» (ФГБОУ ВО СПХФУ Минздрава России) у здоровых добровольцев после приема натощак различных доз препарата при однократном и многократном применении в течение 7 дней.
Материалы и методы. В открытом нерандомизированном КИ приняли участие 48 здоровых добровольцев, разделенных на 6 когорт. Добровольцы когорты 1 принимали по 600 мг этмабена однократно, когорты 2 – по 900 мг однократно, когорты 3 – по 1200 мг однократно. Добровольцы когорты 4 получали суточную дозу 600 мг, когорты 5 – 900 мг, когорты 6 – 1200 мг. Концентрации этмабена в плазме крови определялись методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (ВЭЖХ-МС/МС). Фармакокинетические параметры вычислялись с помощью Microsoft Excel с расширением Boomer (Department of Pharmacokinetics and Drug Metabolism, Allergan, Irvine, CA 92606, США).
Результаты и обсуждение. Фармакокинетические параметры были рассчитаны для 6 когорт по 8 добровольцев после однократного и многократного применения препарата «Этмабен» в дозах 600, 900 и 1200 мг. Максимальная концентрация этмабена (Сmax) в плазме достигалась в среднем за 0,5 ч. Cmax варьировались от 2,708 ± 1,461 мкг/мл до 19,871 ± 4,415 мкг/мл. Максимальный период полувыведения составил 0,874 ± 0,236 ч. Константа элиминации не превышала 1,053 ± 0,149 ч–1. Среднее время удержания (MRT) этмабена в плазме составило не более 1,527 ± 0,272 ч. Среднее значение объема распределения составило более 45 л, а клиренса – более 42 л, что указывает на значительное распределение в тканях и быстрое выведение препарата. Невысокие значения площадей под кривыми «концентрация – время» и высокая скорость элиминации свидетельствуют о минимальной кумуляции этмабена.
Заключение. Были рассчитаны фармакокинетические параметры, построены усредненные фармакокинетические профили в линейных и логлинейных координатах после однократного и многократного применения различных доз исследуемого препарата. Впервые была изучена фармакокинетика препарата этмабена у человека. Полученные результаты позволяют перейти к следующей фазе КИ препарата «Этмабен».
РЕГУЛЯТОРНЫЕ ВОПРОСЫ
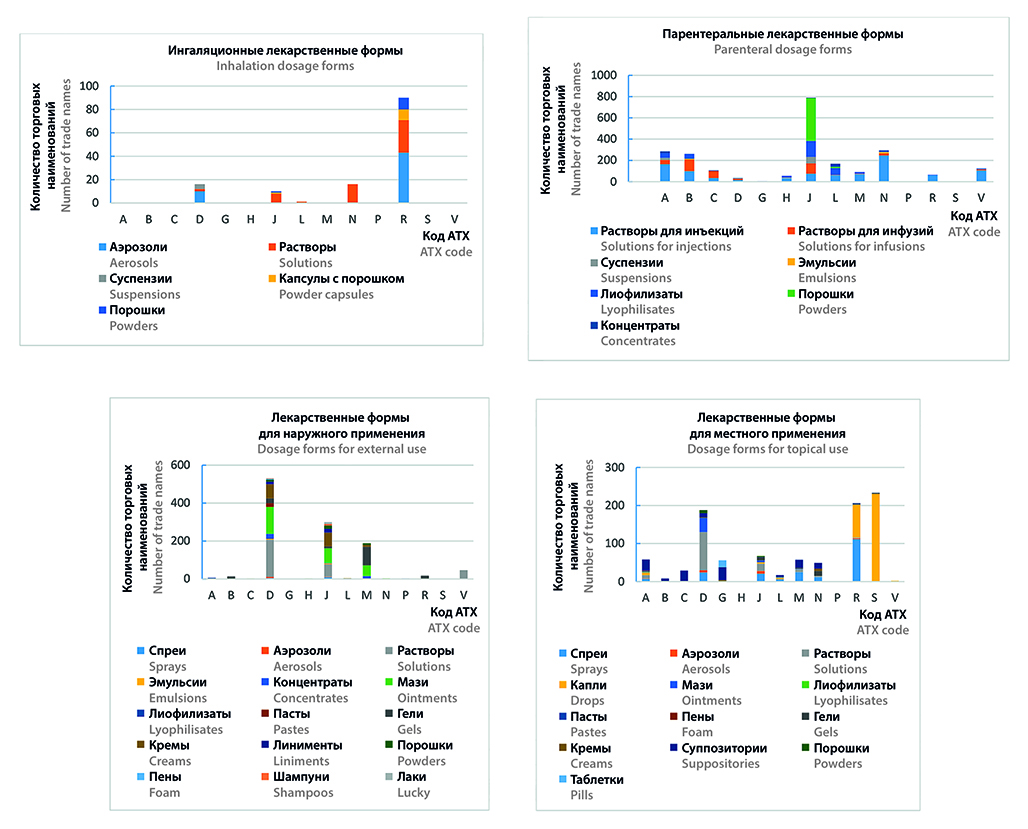
Введение. Стратегия лекарственного обеспечения населения Российской Федерации на период до 2025 года в спектре приоритетных задач выделяет необходимость обеспечения рационального использования, безопасности и качества лекарственных препаратов. При этом применение эффективных медицинских технологий у педиатрических пациентов лимитировано как ассортиментом разрешенных к применению в детской популяции лекарственных препаратов, так и требованиями в части соответствия фармацевтического дизайна препарата назначению в целевой возрастной группе. Российский фармацевтический рынок характеризуется монотонной и стойкой тенденцией к расширению ассортиментной матрицы и увеличению показателей реальной и потенциальной емкости, в том числе в сегменте лекарственных препаратов для педиатрии. Однако, несмотря на ввод в гражданский оборот новых рыночных позиций для детей, постепенное накопление данных о безопасности, клинической и клинико-экономической эффективности препаратов в детской популяции, расширение панели возможностей производственных аптек, изменение правового статуса зарегистрированных препаратов, назначаемых off-label, на основании доказательного опыта применения по новому назначению, вопросы обоснованности врачебных назначений с приемлемым профилем убедительности доказательств в отношении педиатрических пациентов в условиях возникновения и развития ряда патологий остаются открытыми.
Цель. Определить перспективы оптимизации лекарственного обеспечения педиатрических пациентов на основе развития фармацевтического рынка в сегменте лекарственных препаратов для детей.
Материалы и методы. Информационную базу исследования составили данные Минздрава России за 2010–2022 гг., ГРЛС по состоянию на 01.01.2023 г., а также инструкции по медицинскому применению лекарственных препаратов. Границы рынка определяли целевой возрастной группой пациентов в соответствии с рекомендацией Коллегии Евразийской экономической комиссии. Метод контент-анализа использован для поиска научной литературы в электронных базах данных PubMed и eLibrary, анализа информации из инструкций по медицинскому применению лекарственных препаратов (ЛП), ограничительных перечней, ГРЛС, государственного реестра цен на ЖНВЛП. С помощью статистического метода анализа проведен анализ данных заболеваемости. Группировку, ранжирование и систематизацию применяли в рамках структурного анализа заболеваемости, а также анализа ассортиментной матрицы препаратов для педиатрии в рамках сформированных границ рынка. Графический анализ был использован для визуализации данных. Обработка данных осуществлялась с использованием MS Excel 2021.
Результаты и обсуждение. Установлено, что в период с 2010 по 2022 гг. на фоне прироста численности детского населения на 11,22 % отмечается увеличение первичной заболеваемости в целом на 13,41 %. В структуре первичной заболеваемости детей превалируют болезни органов дыхания, составляя 62,61 %. Анализ ассортиментной матрицы национального педиатрического формуляра, охватывающего 554 МНН, демонстрирует, что в рамках фармакотерапевтических групп с кодами J, L, N и Р регистрируется снижение показателей ВОЗ на 16–57 %. Оценка предложения на национальном рынке позволяет заключить, что 19,55 % препаратов, разрешенных к применению в педиатрический практике, противопоказаны пациентам до 12 лет. В результате ранжирования ассортимента по пути введения установлено преобладание пероральных форм, охватывающих 39,88 % ассортиментной матрицы.
Заключение. Оценка динамики заболеваемости в контексте анализа структуры рынка препаратов для педиатрии позволяет выделить приоритетные ниши для фарминдустрии в сегментах лекарственных средств для фармакологической коррекции респираторных заболеваний, а также препаратов для лечения онкологических патологий, аутоиммунных расстройств, ожирения, сахарного диабета и неврологических расстройств. Представленный на сегодняшний день ассортимент лекарственных препаратов с учетом форм выпуска и возрастных ограничений для терапии педиатрических пациентов демонстрирует недостаточное заполнение рынка препаратами в специальных детских лекарственных формах, обеспечивающих приемлемость современных концепций терапии в педиатрии и точное дозирование действующих веществ в соответствии с возрастом ребенка, что, в свою очередь, раскрывает перспективы фармацевтической разработки лекарственных препаратов с дизайном, соответствующим назначению в целевой возрастной группе.
ISSN 2658-5049 (Online)