Научно-производственный рецензируемый журнал «Разработка и регистрация лекарственных средств» - актуальное бесплатное прикладное издание и информационный портал для специалистов, задействованных в сфере обращения лекарственных средств. Журнал предназначен для фармацевтических предприятий-производителей и их сотрудников из отделов разработки, контроля качества, регистрации, производства и развития; сотрудников лабораторных центров, контрактно-исследовательских организаций, научных и образовательных учреждений. Индексируется в российских и международных реферативных и полнотекстовых базах, включен в наукометрические базы данных РИНЦ и Scopus, входит в "Белый список" научных изданий и Перечень ВАК (категория К1).
Наименование и содержание научных работ, публикуемых в журнале «Разработка и регистрация лекарственных средств», должно соответствовать отраслям науки:
- 3.3.6. – фармакология, клиническая фармакология (медицинские науки, фармацевтические науки, биологические науки);
- 3.4.1. – промышленная фармация и технология получения лекарств (фармацевтические науки);
- 3.4.2. – фармацевтическая химия, фармакогнозия (фармацевтические науки).
Основные пять тематических разделов журнала «Разработка и регистрация лекарственных средств» включают цикл развития лекарственного средства от его создания до получения регистрационного удостоверения. Первый раздел посвящен поиску и разработке новых лекарственных средств, второй - фармацевтической технологии и рассматривает научные и практические направления от разработки и производства исходных фармацевтических ингредиентов, технологий и оборудования – до создания стандартных и терапевтически эффективных лекарственных препаратов. Третий раздел описывает аналитические методики контроля качества; четвертый раздел посвящен подходам к оценке эффективности и безопасности лекарственных средств, проведению долклинических и клинических исследований; в пятом разделе рассматриваются вопросы валидации методик, подготовки регистрационного досье, жизненный цикл лекарственного препарата в GxP окружении.
Текущий выпуск
ОТ РЕДАКЦИИ
Представляем вашему вниманию новое интервью в рамках цикла «Мнение лидеров». В этот раз мы поговорили с директором федерального бюджетного учреждения «Государственный институт лекарственных средств и надлежащих практик» (ФБУ «ГИЛС и НП») Шестаковым Владиславом Николаевичем. В роли интервьюера выступила Кульджанова Наталья Вячеславовна, директор научно-производственного журнала «Разработка и регистрация лекарственных средств».
В пятой части статьи представлены сведения о функции Аптекарского приказа по снабжению Российского государства лекарственным растительным сырьем. Лекарственные растения закупались за границей, в московских торговых рядах, а также разводились и интродуцировались в аптекарских огородах. Со временем этой работе Аптекарского приказа уделялось все больше внимания, и эта функция постепенно превращалась в повинность.
Серия жидкостных хроматографов «Скороход» производится по полному циклу на собственных мощностях семейного предприятия Sevko & Co в Пушкинском районе Подмосковья. Эти ВЭЖХ занимают уникальное положение на российском рынке аналитического оборудования не только благодаря максимальной локализации всех деталей в рамках одного предприятия и полной независимости прибора от дефицитных западных компонентов. Ряд технических решений, примененных в приборе, позволяет поставить Скороход на один уровень с западными производителям, покинувшими российский рынок. Некоторые решения являются уникальными и по мировым меркам. В статье речь пойдет об автодозаторе из серии «Скороход», работающем по схеме прямого дозирования пробы из иглы (split-loop), привычной для западных крупнейших производителей ВЭЖХ, но до сих пор не доступной для российских пользователей.
ПОИСК И РАЗРАБОТКА НОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Введение. Одним из самых распространенных поражений суставов является остеоартрит. Численность больных стремительно растет, и, по прогнозам, к 2050 г. количество людей в мире, заболевших остеоартритом, превысит 1 миллиард. В ряде европейских стран в качестве лечения применяется процедура радиосиновиортеза. В ее основе лежит облучение синовии сустава при внутрисуставном введении различных радиофармпрепаратов, содержащих β-излучающие радионуклиды.
Цель. Изучение возможности создания радиофармацевтической композиции для радиосиновиортеза на основе рения-188 и гиалуроновой кислоты в качестве стабилизатора.
Материалы и методы. Раствор натрия перрената, 188Re получали из генератора 188W/188Re «ГРЕН-1» (АО «ГНЦ РФ – ФЭИ», Россия). Активность 188Re измеряли на дозкалибраторе ISOMED 2010 (PTW-Freiburg, Германия). Метод тонкослойной хроматографии на пластинках с тонким слоем силикагеля на алюминиевой подложке в ацетоне использовали для определения радиохимической чистоты. Измерение активности участков хроматограммы проводили на сканере хроматограмм Scan-RAM (LabLogic Systems Ltd., Великобритания). С помощью рН-метра S20 Seven Easy (МЕTTLER TOLEDO, Швейцария) измеряли рН. Размер частиц определяли методом лазерной дифракции на приборе LA-350 с диапазоном определения 0,1–1000 мкм (HORIBA, Япония). Накопление 188Re в суставе определяли на гамма-счетчике Wizard 2480 (PerkinElmer, США) после внутрисуставного введения композиции половозрелым крысам, конвенциональным альбиносам (самки).
Результаты и обсуждение. В рамках исследований проведено сравнение физико-химических свойств синтезированных композиций, полученных различными способами. Найдена оптимальная концентрация гиалуроновой кислоты и определена возможность лиофилизации реагента, содержащего гиалуроновую кислоту и другие вспомогательные вещества. Изучено биологическое поведение синтезированных композиций после внутрисуставного введения половозрелым крысам, конвенциональным альбиносам (самки).
Заключение. Разработана радиофармацевтическая композиция, содержащая рений-188 и гиалуроновую кислоту, с радиохимической чистотой более 95 %. Накопление радионуклида в коленном суставе составляло более 96 % через 3 ч после внутрисуставного введения. Данная композиция представляет интерес для дальнейшего изучения в качестве радиофармацевтического лекарственного препарата для радиосиновиортеза.
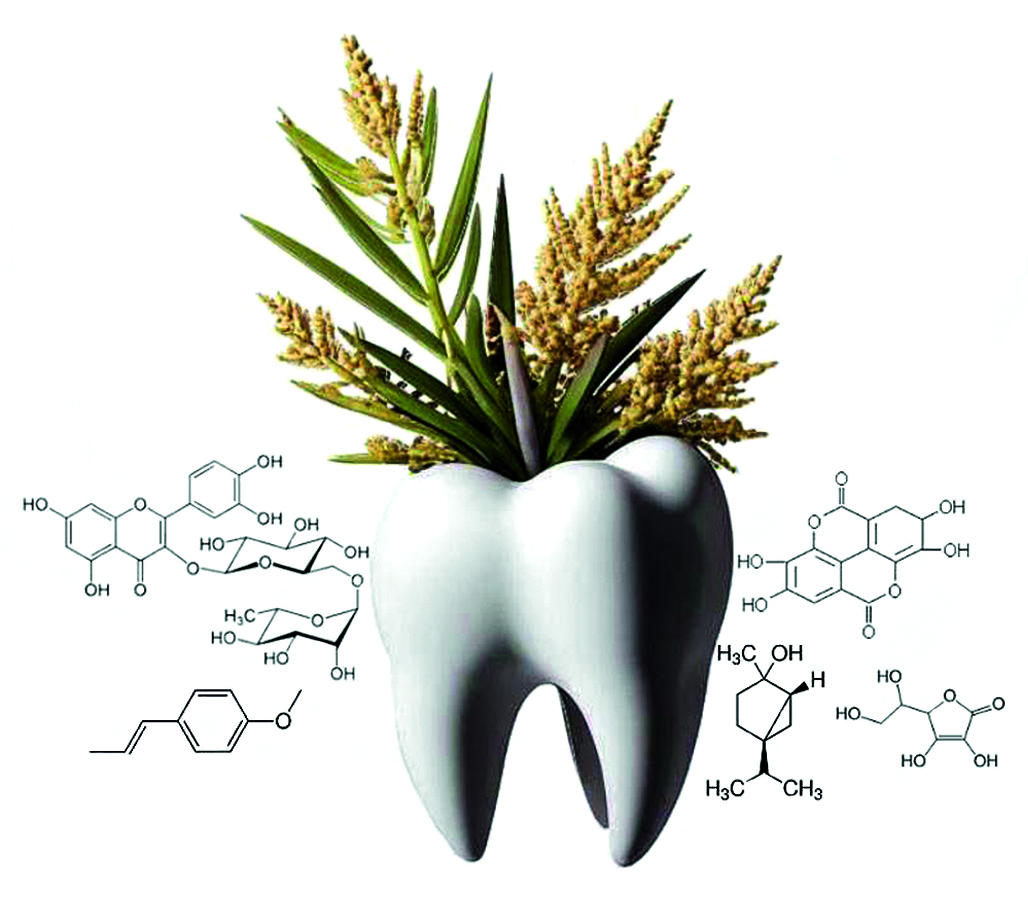
Введение. Применение синтетических лекарственных средств сопряжено с возникновением ряда побочных эффектов. При выборе терапии для коррекции симптомов и лечения таких стоматологических заболеваний, как стоматит, пародонтит, гингивит, хейлит, предпочтительнее использовать лекарственные растительные средства в сочетании с традиционной терапией, которые бы улучшали устойчивость тканей пародонта к патогенным микроорганизмам. Препараты растительного происхождения обладают высокой эффективностью и хорошей переносимостью, что позволяет использовать их в современной медицине.
Цель. Разработка лекарственного сбора, обладающего противомикробным, противовоспалительным, ранозаживляющим действием.
Материалы и методы. В качестве материалов исследования использовали следующие субстанции и реактивы: сбор, содержащий траву тысячелистника, траву череды трехраздельной, соплодия ольхи и плоды аниса в соотношении 1 : 1 : 1 : 1, диклофенак натрия, аскорбиновую кислоту, фосфатный буфер, цитрат натрия, люминол, железа (II) сульфат, гепаринизированную кровь, зимозан, физиологический раствор, 2%-й раствор формалина, 10%-й раствор нейтрального формалина, гематоксилин, эозин. Изучение противомикробной активности проводили путем сравнения задержки роста патогенных микроорганизмов, антиоксидантная активность изучалась на хемолюминометре ХЛМ-003 (Россия), гематологические тесты на мышах проводились с помощью программного комплекса ImageJ, Sysmex KX-21N (Sysmex, Япония), микроскопа Leica RM 2145 (Leica Biosystems Nussloch GmbH, Германия), бинокулярного микроскопа Leica CME (Leica Biosystems Nussloch GmbH, Германия).
Результаты и обсуждение. Проведена оценка противовоспалительной, антиоксидантной, ранозаживляющей и противомикробной активности растительного сбора. По результатам эксперимента установлено, что сбор обладает антиоксидантной, ранозаживляющей и выраженной противовоспалительной активностью, сопоставимой с препаратом сравнения.
Заключение. Разработан растительный сбор, обладающий противовоспалительным, противомикробным и регенерирующим действием.
Введение. Диарилхинолины принято считать группой оптимальных кандидатов на роль противотуберкулезных препаратов (ПТП) для лечения туберкулеза, вызванного Mycobacterium tuberculosis с множественной лекарственной устойчивостью.
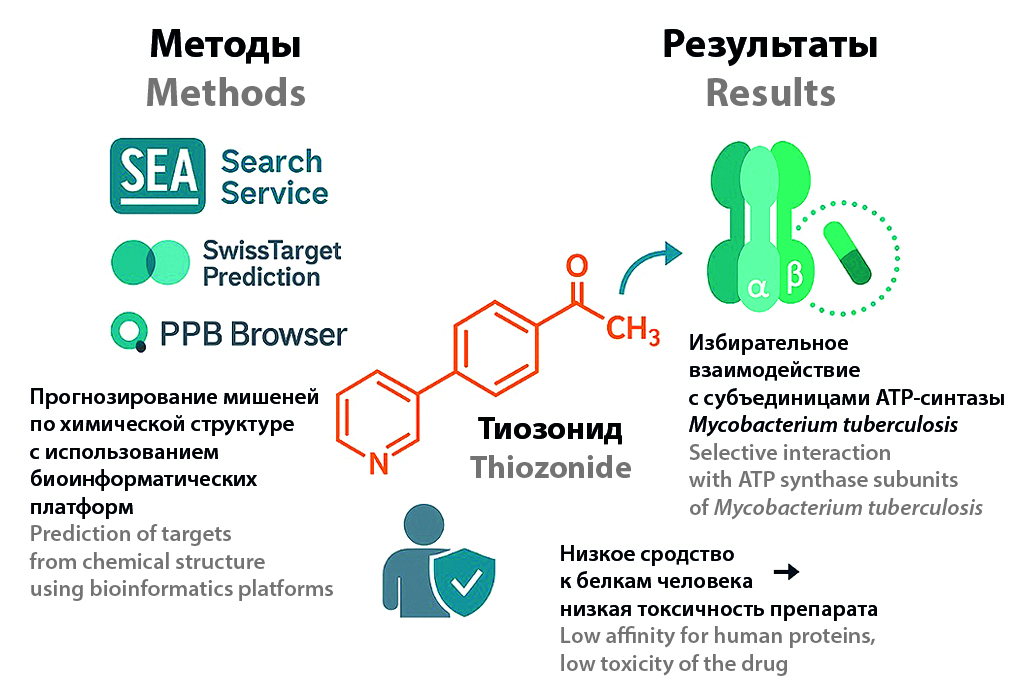
Цель. Провести компьютерный анализ и оценку потенциальных молекулярных мишеней отечественного противотуберкулезного препарата тиозонида с использованием современных биоинформатических подходов.
Материалы и методы. Для прогнозирования мишеней лекарства был применен сервис SEA Search Service, который, опираясь на степень химического сходства молекул, рассчитываемую по коэффициенту Танимото, предсказывает воздействие исследуемого лиганда на известные мишени. Для анализа были отобраны соединения из базы данных ChEMBL, поиск структурно подобных молекул осуществляли с расчетом меры сходства по коэффициенту Танимото. Возможные мишени тиозонида предсказывали с помощью сервиса PPB (Polypharmacology Browser for Target Prediction), используя шесть разных фингерпринтов и четыре их сочетания. Выявлен значительный потенциал тиозонида для связывания с белками микобактерий, в том числе M. tuberculosis. Было выполнено компьютерное прогнозирование возможных биологических мишеней тиозонида с применением сервиса PPB (Polypharmacology Browser for Taget Prediction in ChEMBL) для анализа полифармакологии. Инициированный на основе химической структуры тиозонида в формате SMILES поисковый запрос позволил выявить среди различных мишеней, представленных в базе данных ChEMBL наиболее вероятные для взаимодействия с изучаемым соединением.
Результаты и обсуждение. Согласно результатам компьютерного скрининга, тиозонид продемонстрировал наиболее выраженную прогнозируемую активность в отношении различных представителей рода Mycobacterium, в том числе M. tuberculosis. На основании результатов исследования наиболее вероятными мишенями с участком связывания тиозонида оказались субъединицы бактериальной АТФ-синтазы – фермента, который выполняет центральную функцию в энергетическом обмене клетки, связывая процессы синтеза и гидролиза АТФ с перемещением протонов через мембрану. В качестве возможных мишеней для молекулы тиозонида в этом сервисе также были выделены некоторые белки человека, однако сродство тиозонида к этим мишеням у данных белков можно считать довольно низким.
Заключение. Результаты исследований демонстрируют избирательную активность тиозонида в отношении микобактерий, в частности штаммов M. tuberculosis. Тиозонид селективно взаимодействует с ключевыми субъединицами АТФ-синтазного комплекса бактерий, нарушая его каталитическую функцию. Тиозонид демонстрирует низкое сродство к мишеням организма человека (показатель аффинности не выше 0,1).
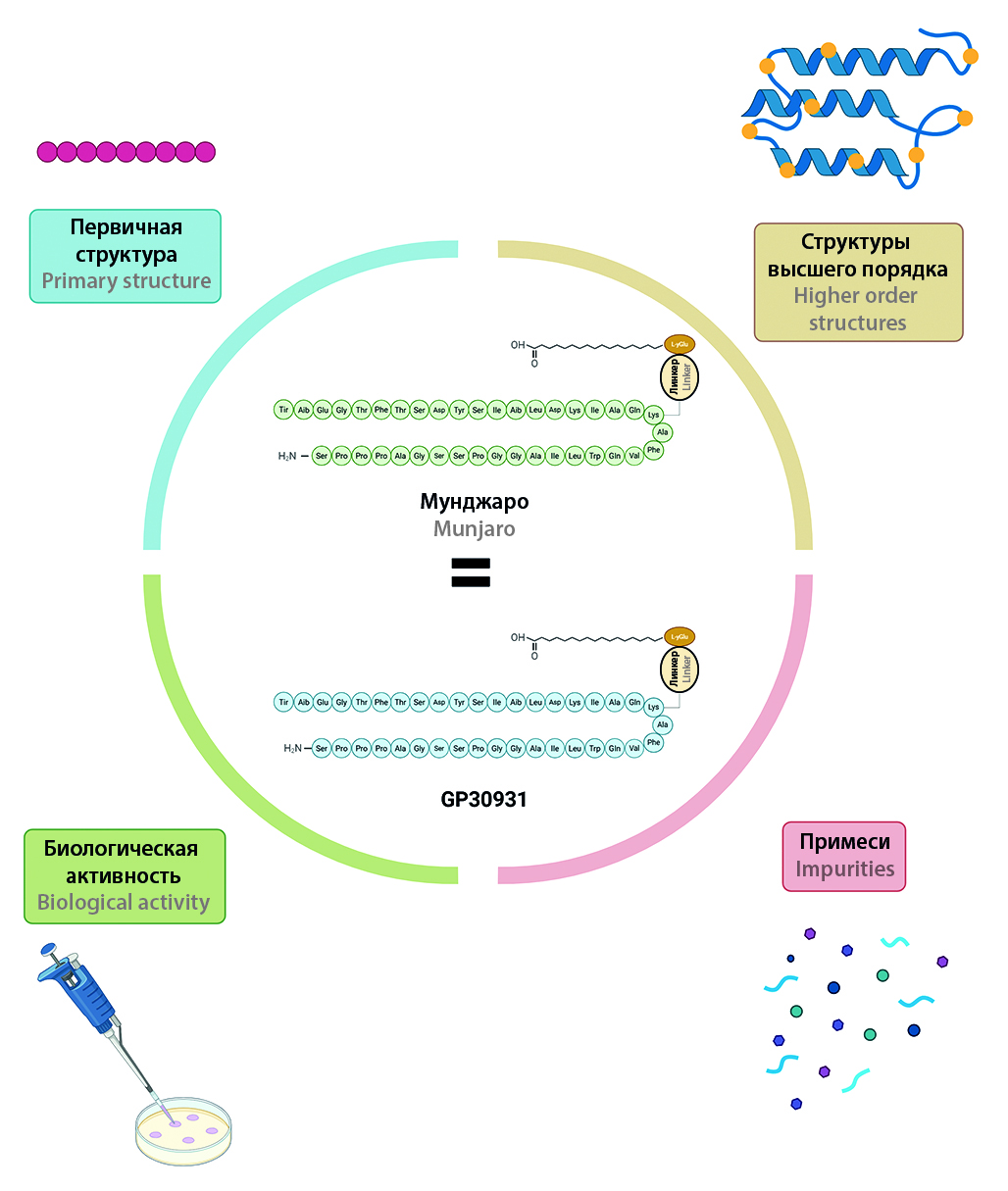
Введение. Метаболический синдром – мультифакторный комплекс метаболических нарушений, сопровождающийся сахарным диабетом 2 типа и абдоминальным ожирением. В фармакологической коррекции ожирения и сахарного диабета 2 типа наибольший эффект демонстрируют двойные агонисты глюкагоноподобного пептида-1 (GLP-1) и глюкозозависимого инсулинотропного полипептида (GIP), в частности тирзепатид. Оригинальный препарат («Мунджаро», мнн: тирзепатид) не зарегистрирован в Евразийском экономическом союзе (ЕАЭС), что ограничивает его доступность для пациентов и приводит к необходимости разработки отечественного дженерика.
Цель. Проведение физико-химической и биологической характеризации препарата Седжаро® (GP30931) в сравнении с оригинальным препаратом Мунджаро® для установления их сопоставимости.
Материалы и методы. Исследованы три серии каждого препарата (раствор для подкожного введения, 25 мг/мл). Первичную структуру проверяли с помощью высокоэффективной жидкостной хроматографии в сочетании с масс спектрометрией (ВЭЖХ-МС), пептидного картирования и ЯМР (2D-ЯМР-1H-1H TOCSY). Вторичную структуру, структуры высшего порядка и агрегацию оценивали методами кругового дихроизма (КД), ядерного магнитного резонанса высокого разрешения (ЯМР), квантового выхода флуоресценции (КФ) и динамического рассеяния света (DLS). Профиль примесей анализировали с использованием эксклюзионной и обращенно фазовой ВЭЖХ. Функциональную активность определяли в клеточных тестах по активации кальциевых потоков через рецепторы GLP-1 и GIP с оценкой полумаксимальной эффективной концентрации (EC50); эквивалентность подтверждали методом двух односторонних тестов (TOST, 90 % доверительный интервал).
Результаты и обсуждение. ВЭЖХ-МС и картирование подтвердили идентичные массу (4 810,52 Да) и аминокислотную последовательность. Спектры ЯМР, профили КД и КФ, а также ДЛС полностью совпадали, что позволяет заключить, что вторичные и третичные структуры препаратов структурно идентичны. Содержание всех видов примесей у GP30931 не превышало значений «Мунджаро». Различие значений EC50 для активации GLP-1 и GIP рецепторов составило ≤5 %, сравнительная биологическая активность находились в пределах 0,80–1,25.
Заключение. Комплекс проведенных исследований с использованием ортогональных методов показал, что «Седжаро» (GP30931) и «Мунджаро» структурно идентичны, сопоставимы по профилю примесей и биологически эквивалентны. Полученные данные вносят значимый вклад в научное обоснование эквивалентности воспроизведенного препарата тирзепатида и референтного оригинального препарата, тем самым обеспечивая надежную основу для дальнейшей регистрации и клинического применения Седжаро® без проведения дополнительных клинических исследований.
ФАРМАЦЕВТИЧЕСКАЯ ТЕХНОЛОГИЯ
Введение. Прямое прессование – один из самых предпочтительных методов производства таблетированных лекарственных форм с точки зрения эффективности, так как он позволяет максимально сократить технологическую схему до уровня «смешивание – таблетирование – фасовка и упаковка»). Однако для применения этого метода требуются вспомогательные вещества, которые обладают соответствующей сыпучестью и прессуемостью. Одним из широко используемых представителей подобных вспомогательных веществ является гранулированная лактоза. В рамках данной работы были произведены образцы чистой гранулированной лактозы методом грануляции в псевдоожиженном слое и грануляцией с высоким усилием сдвига с целью сравнения фармацевтико-технологических свойств продукта, полученного по разным технологиям, и модельных таблеток.
Цель. Выбор предпочтительного способа получения гранулированной лактозы методом влажной грануляции без использования связующих веществ.
Материалы и методы. Лактоза 80 меш (Ningbo Samreal Chemical Co., Ltd., Китай и Aurora Industry Co. Ltd., Китай), лактоза 200 меш (DMV-Fonterra Excipients GmbH & Co. KG, Германия) использованы в качестве исходного сырья. Установка псевдоожиженного слоя Hüttlin использована для грануляции и для сушки гранулята. Грануляция с высоким усилием сдвига выполнена в миксере-грануляторе Evio G10H (ООО «ФармТехнолоджис», Россия). Таблетирование проведено на роторном таблеточном прессе. Вибросита, тестер насыпной плотности и тестер сыпучести использовались для анализа порошков, тестер прочности и распадаемости – для анализа таблеток.
Результаты и обсуждение. Были испытаны три подхода к получению лактозы для прямого прессования: 1) грануляция лактозы в псевдоожиженном слое; 2) модификация поверхности лактозы 80 меш распылением раствора лактозы в псевдоожиженном слое; 3) грануляция лактозы с использованием усилия сдвига. Первым критерием приемлемости для оценки полученных образцов была выбрана сыпучесть. При достижении необходимой сыпучести переходили к таблетированию модельной смеси. Полученные результаты демонстрируют, что наилучший продукт получается с помощью грануляции с высоким усилием сдвига.
Заключение. Проведено сравнение различных способов получения гранулированной лактозы. По результатам сравнения выбрана технология грануляции с усилием сдвига. Свойства полученного гранулята и модельных таблеток соответствуют установленным критериям приемлемости.
Введение. Актуальным направлением современной разработки лекарственных средств является создание стимулочувствительных систем, способных к фазовому переходу «раствор – гель» в организме человека под воздействием различных физиологических факторов (ионный состав среды, температура, pH и др.). Одним из наиболее перспективных стимулочувствительных природных полимеров считается деацетилированное производное основного структурного компонента панцирей ракообразных, хитина, – хитозан. Этот полимер обладает доказанной высокой совместимостью с тканями животных, биоразлагаемостью и собственным антимикробным действием, что позволяет неограниченно его использовать в фармацевтических композициях. Также важно отметить высокую распространенность хитозана в природе, что делает его легкодоступным сырьем для создания новых лекарственных форм и, в частности, для импортозамещения зарубежных полимеров в отечественной фармацевтической технологии.
Текст. Целью представленного обзора стала систематизация информации и исследований касательно хитозана, его производства, физических и химических свойств и факторов, от которых последние зависят, и, самое важное, фармацевтических композиций на основе изучаемого полимера и его модификаций и стимулов, за счет которых происходит фазовый переход в системах доставки, включающих этот деацетилированный природный полисахарид. Хитозан – аминополисахарид, состоящий из β-(1 → 4)-связанных остатков D-глюкозамина и N-ацетил-D-глюкозамина, известен в фармацевтической промышленности с середины ХХ века. За годы исследований были доказаны его биосовместимость, мукоадгезивность и гелеобразующие способности в водных растворах при pH в диапазоне до 6–7. В наиболее исследованные композиции на основе хитозана включались различные низкомолекулярные вспомогательные компоненты для достижения in situ перехода его водных растворов в физиологических условиях, однако многие сшивающие компоненты либо приводили к формированию стационарных гидрогелей, либо обладали токсичностью. Одним из самых перспективных и исследованных сочетаний на сегодняшний день представляется комбинация хитозана с бета-глицерофосфатом. Другой интересной стратегией придания хитозану стимулочувствительных свойств является модификация свободных аминогрупп цепи полимера с помощью других высокомолекулярных соединений путем их сшивания через иминные или амидные связи (как, например, в метоксиполиэтиленгликоль-хитозане), которые способны гидролизоваться в среде организма. Таким образом можно повышать растворимость хитозана и достигать pH- и/или термочувствительности у изучаемых полимеров.
Заключение. В ходе написания обзора были освещены наиболее важные аспекты производства и модификации хитозана, а также продемонстрированы способы придания хитозану pH- или термочувствительных свойств посредством различных стратегий и показаны их преимущества и недостатки. Важно отметить, что не было найдено работ, которые доказывали бы наличие стимулочувствительных свойств у индивидуальных растворов хитозана.
Введение. Профессиональный подход к разработке лекарственного препарата (ЛП), а в частности лекарственной формы (ЛФ), включает в себя комплексный анализ активной фармацевтической субстанции (АФС) и вспомогательных веществ (ВВ). Поэтому подробное изучение физико-химических и технологических свойств фармацевтической субстанции является основополагающим шагом при разработке ЛП, благодаря которому можно выбрать подходящую ЛФ и спрогнозировать технологический процесс исходя из характеристик лекарственного вещества.
Цель. Целью данной работы является изучение технологических и физико-химических характеристик доксепина гидрохлорида.
Материалы и методы. Исследуемая активная фармацевтическая субстанция – доксепина гидрохлорид ((E)-3-(дибензо[b,e]оксепин-11(6Н)-илиден)-N,N-диметилпропан-1-амина гидрохлорид) (экспериментальный образец). При проведении экспериментов использовали: сканирующий электронный микроскоп JSM-6510LV (JEOL, Япония), вибросито CISA RP 200N (CISA Cedaceria Industrial S.L., Испания), тестер насыпной плотности ERWEKA SVM 102 (ERWEKA GmbH, Германия), тестер сыпучести ERWEKA GTL (ERWEKA GmbH, Германия), сушильный шкаф BINDER FD 115 (BINDER GmbH, Германия).
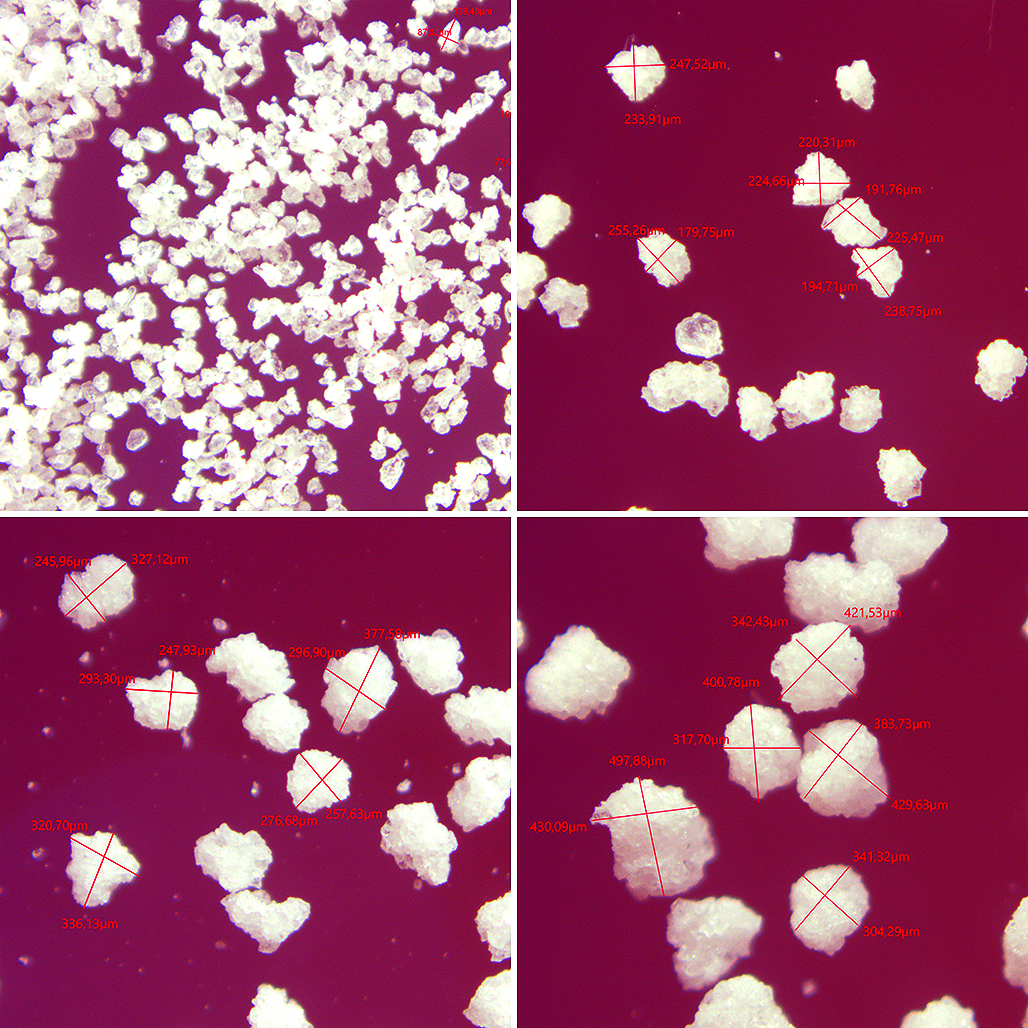
Результаты и обсуждение. В ходе ряда экспериментов были получены данные о характере кристаллов, растворимости, фракционном составе, сыпучести и насыпной плотности исследуемого порошка. В результате изучения АФС было установлено, что субстанция имеет среднюю степень сжимаемости, не обладает свойством сыпучести из-за большой статики, что характерно для подтвержденной формы кристаллов исследуемого вещества. Перечисленные выше технологические характеристики АФС следует учитывать при выборе оптимальной ЛФ.
Заключение. В результате проведенных в данной статье экспериментов было установлено, что АФС доксепина гидрохлорида представляет собой белый кристаллический несыпучий порошок со средней насыпной плотностью и степенью прессуемости. Сильная статика образца доксепина объясняется формой его кристаллов в виде пластин с большой площадью соприкосновения между собой. Субстанция хорошо растворима в воде, спирте и растворе ПЭО-400 : вода в соотношении 1 : 2. Описанные выше технологические свойства не позволят произвести твердую лекарственную форму методом прямого прессования без использования вспомогательных веществ, улучшающих исходные технологические характеристики лекарственного вещества. Альтернативным способом технологии изготовления может быть использование грануляции либо же выбор иной ЛФ (например, жидкой лекарственной формы, ЖЛФ).
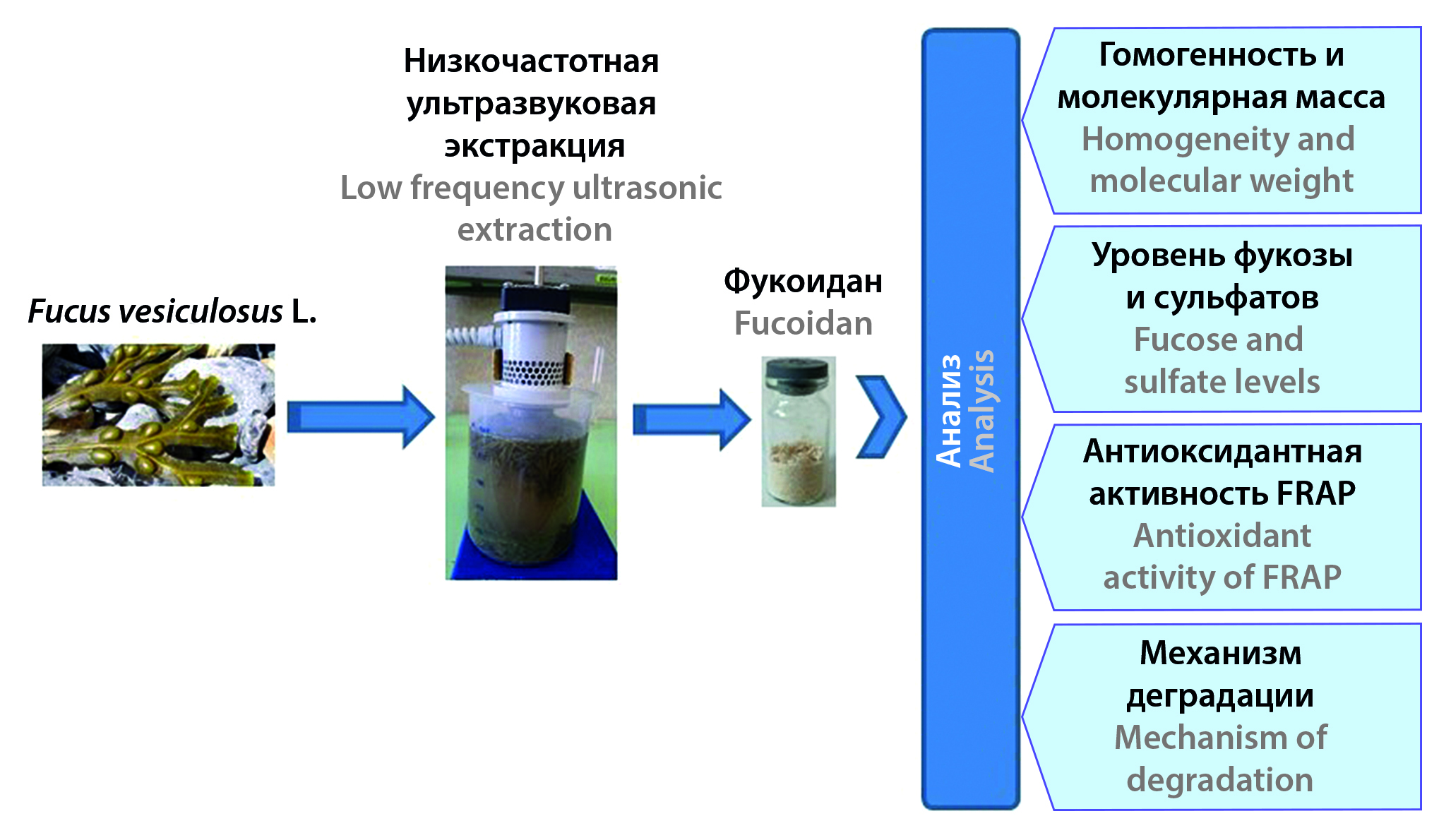
Введение. Перспективным источником для выделения фукоидана является Fucus vesiculosus L. – широко распространенный вид бурых водорослей. В последние годы активно изучается возможность применения фукоидана в медицине и фармации. Метод извлечения полисахаридов существенно влияет на их характеристики и функции. Для повышения эффективности экстракции широко исследуется возможность использования ультразвука (УЗ).
Цель. Изучение влияния времени низкочастотной УЗ-экстракции бурых водорослей F. vesiculosus на кинетику деградации фукоидана и его свойства.
Материалы и методы. В качестве сырья использовали свежемороженые бурые водоросли F. vesiculosus. УЗ-экстракцию проводили с помощью ультразвуковой установки УЗТА-0,4/22-ОМ с частотой колебаний 22 кГц и при температуре 25 °С. Экстракт получали при температуре 60 °С методом динамической мацерации. Гомогенность и молекулярную массу фукоидана анализировали методом высокоэффективной эксклюзионной хроматографии (ВЭЭХ). ИК-фурье-спектры фукоидана получали на спектрометре VERTEX 70. Количественное определение фукозы и сульфатов выполнено ВЭЖХ и спектрофотометрическим методом соответственно. Антиоксидантную активность (АОА) фукоидана оценивали с использованием теста железовосстанавливающей антиоксидантной способности (FRAP). Математическую и статистическую обработку результатов выполняли в соответствии с требованиями Государственной фармакопеи (ГФ) РФ XV издания с помощью программного обеспечения MO Excel 2007.
Результаты и обсуждение. Рассчитанная скорость деградации фукоидана составила 19,5 %/ч. Константа скорости реакции и период полураспада, рассчитанные по модели второго порядка (R2 > 0,97), составили 5,8 · 10–6 моль/(г · мин) и 110 мин. УЗ-деградация фукоидана происходила преимущественно за счет случайного разрыва цепи (R2 > 0,98). Методом ИК-фурье-спектрометрии установлено, что предварительные структуры фукоидана без УЗ-обработки и после экстракции с УЗ-обработкой не были изменены. Анализ антиоксидантной активности показал, что фукоидан после УЗ-экстракции, несмотря на снижение молекулярной массы, демонстрировал значительную антиоксидантную активность in vitro.
Заключение. Впервые показано изменение структурных и антиоксидантных свойств фукоидана, вызванное низкочастотной УЗ-обработкой при экстракции. УЗ-экстракция фукоидана приводит к снижению средней молекулярной массы и деградации фукоидана без значительного разрушения сульфатных групп. В целом это исследование показывает, что низкочастотная ультразвуковая экстракция, которая является мягким, экологичным методом, осуществляемым за короткий промежуток времени, может быть эффективно использована для экстракции фукоидана без критического изменения молекулярной массы и антиоксидантной активности.
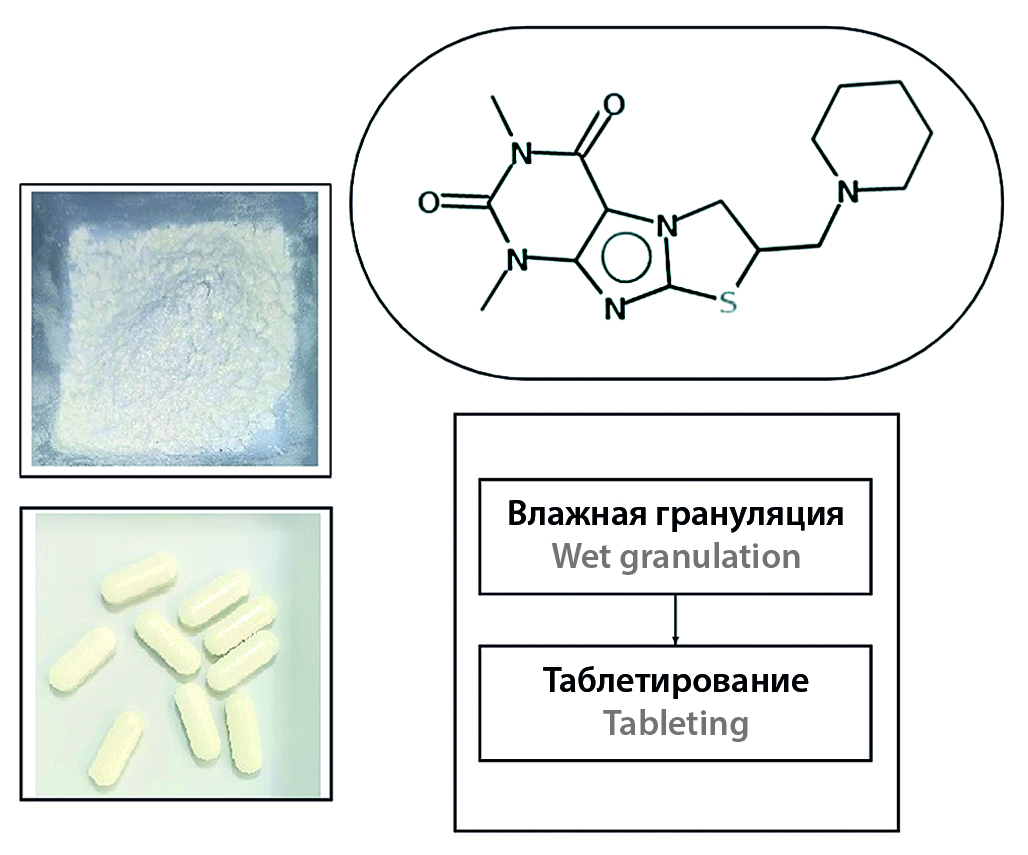
Введение. 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантин является перспективным веществом-индуктором монооксигеназной системы гепатоцитов, по данным доклинических исследований повышающим детоксицирующую функцию гепатоцитов на моделях неконъюгированной гипербилирубинемии, ишемии печени, токсичеcкого гепатита, острой гипобаричеcкой гипоксии. Ранее показана возможность получения таблеток на основе 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина методом прямого прессования, однако при дальнейшей разработке с увеличением загрузки таблеточной массы выявлены сложности с полнотой заполнения матрицы таблетпресса, что связано с недостаточной сыпучестью таблеточной массы. Это приводило к ухудшению однородности дозирования и увеличению количества брака по параметру средней массы. В рамках дальнейшей фармацевтической разработки и улучшения технологических свойств таблеточной массы предпринята попытка применить метод влажной грануляции для получения таблеток 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина с сохранением состава наполнителей (лактозы моногидрата и микрокристаллической целлюлозы) и формы, выдерживающих испытания согласно Государственной фармакопее РФ. Для этого изучено влияние связывающих веществ, антифрикционных агентов и размера гранул на технологические свойства таблетируемой массы, проведен анализ распадаемости и прочности таблеток.
Цель. Разработка состава для влажного гранулирования 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F] ксантина с получением гранул, обладающих оптимальными технологическими свойствами для получения таблеток высокого качества, выдерживающих испытания согласно Государственной фармакопее РФ.
Материалы и методы. Для получения гранул в качестве исходного сырья использовали фармацевтическую субстанцию 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина (серия DPDX280424001). Использовали как наполнители лактозы моногидрат (200-559-2, ООО «Нефтегазхимкомплект», Россия), микрокристаллическую целлюлозу (100-32-2, Silverline chemicals Ltd., Индия), крахмал картофельный и гидроксипропилцеллюлозу (ZW180113, Fengchen Group Co., Ltd., Китай), воду очищенную. Связывающие вещества представлены 5%-м гелем поливинилпирролидона, 5%-й крахмальной слизью и 5%-м гелем гидроксипропилметилцеллюлозы. Как антифрикционные вещества рассматривали магния стеарат (209-150-3, Ataman Chemicals, Турция), кальция стеарат и тальк (ООО «Агат-Мед», Россия). Таблеточные массы оценивали по показателям силы выталкивания таблетки из матрицы, сыпучести, насыпной плотности, прессуемости. В качестве пресс-станка использовали пресс для таблеток EP-1 (ERWEKA GmbH, Германия). Оценивали прочность на раздавливание, распадаемость и среднюю массу полученных таблеток. Анализ получаемых таблеток проводили в соответствии с Государственной фармакопеей Российской Федерации по параметрам «средняя масса», «прочность на раздавливание», «распадаемость».
Результаты и обсуждение. На основе латинского квадрата с применением шкалы желательности Харрингтона с последующим дисперсионным анализом экспериментальных данных выявлено, что наибольшее влияние на сыпучесть гранул 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина оказывает размер (влияние до 77,68 %, оптимальный размер гранул 0,5–1 мм). Влияние связывающих агентов на распадаемость и прочность составило до 99,38 и до 95,35 % соответственно. Получение гранул с применением в качестве связывающего агента 5%-й крахмальной слизи позволило увеличить сыпучесть таблеточной массы с 3,5–4,0 до 12,5–12,9 г/с в сравнении с сыпучестью аналогичного состава таблеточной массы без применения метода влажной грануляции. Отклонение в средней массе не превышало 5 %, полученные таблетки не имели дефектов, сколов, выдерживали испытания на прочность и распадаемость.
Заключение. В результате проведенных экспериментов изучено влияние влажной грануляции на технологические свойства таблеточной массы 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина. Полученные гранулы обладали повышенной сыпучестью в сравнении с исходной таблеточной массой, что позволило исключить неполную заполняемость матрицы таблетпресса, улучшило однородность дозирования, исключило образование брака и дефектов таблеток с сохранением их прочности и распадаемости в сравнении с методом прямого прессования. Улучшение сыпучести смеси за счет образования гранул также позволяет рассматривать в качестве дополнительных лекарственных форм 6,8-диметил-2-пиперидинометил-2,3-дигидротиазоло[2,3-F]ксантина капсулы и саше-пакеты.
Введение. О влиянии лекарственной формы на фармакологический эффект известно с древних времен. Стратегия получения мицеллярных лекарственных форм для активных противоопухолевых субстанций была сформулирована в прошлом веке. Однако широкое практическое распространение она получила в последние десятилетия. Это во многом связано с успехами в области синтеза новых структурных компонентов для формирования мицеллярного носителя, а также с получением более глубоких знаний о биохимических процессах, происходящих в опухолевой клетке.
Текст. Данный обзор посвящен достижениям в области применения наномицеллярных форм противоопухолевых препаратов с целью повышения эффективности терапии рака, которые охватывают период с 2019 по 2024 гг. С этой целью рассмотрены и проанализированы вспомогательные вещества, используемые для получения наномицеллярных форм противоопухолевых субстанций, на примере доцетаксела, паклитаксела, доксорубицина, фотосенсибилизаторов. Создание мицеллярных форм позволило по-новому взглянуть на эти известные в онкологической практике вещества.
Заключение. Имеющиеся достижения в области применения наномицелл для повышения эффективности противоопухолевых субстанций, несомненно, показывают перспективность развития этого технологического направления. Однако остается еще много нерешенных вопросов, связанных как со стабильностью наномицелл при введении в организм, так и с правовым регулированием в области создания и внедрения этой новой фармацевтической формы. Эти вопросы предстоит еще решить фармацевтической науке.
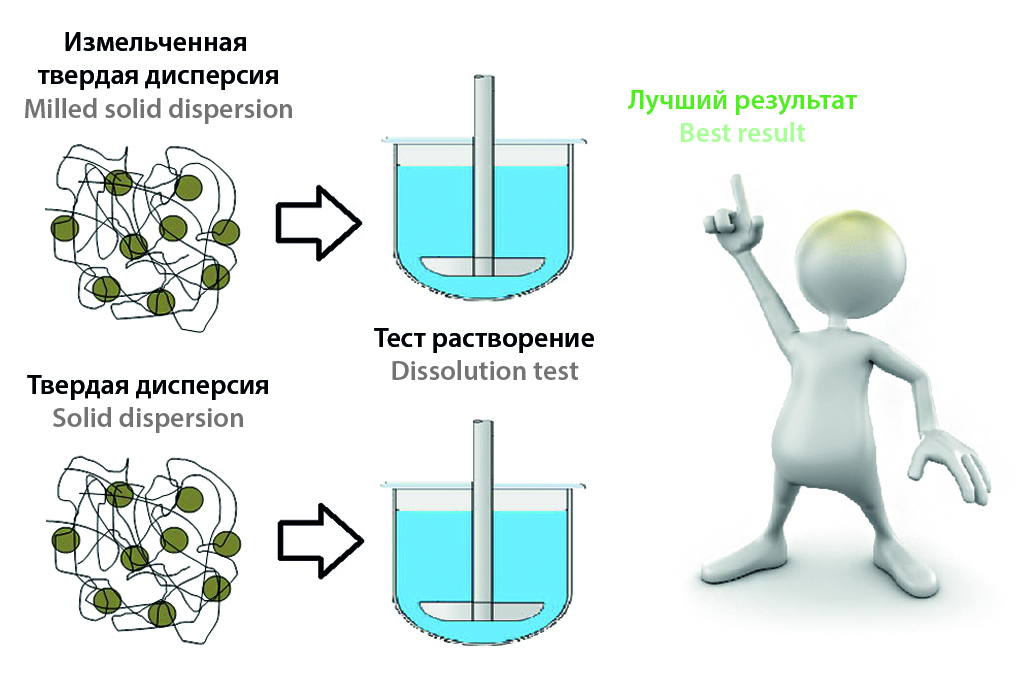
Введение. Применение метода твердых дисперсных систем для увеличения растворимости липофильных активных фармацевтических субстанций является промышленно применимым при использовании разных технологий, но в литературных источниках недостаточно отражено влияние размера частиц на растворение данных систем в зависимости от метода.
Цель. Изучение влияния размера частиц аморфных твердых дисперсных систем «дарунавир – водорастворимый полимер», полученных методами удаления растворителя и экструзии горячего расплава, на растворение дарунавира в биологическом интервале рН 1,2; 4,5 и 6,8.
Материалы и методы. Аморфные твердые дисперсные системы получены двумя способами: удалением растворителя и экструзией горячего расплава. Аморфность определена методами рентгеновской порошковой дифракции и электронной микроскопией. Эффективность дисперсных систем сравнивали по результатам теста «Растворение» порошков, механически измельченных до одинакового размера частиц, в биологическом интервале рН. Концентрация дарунавира в растворе определена с помощью высокоэффективной жидкостной хроматографии с детектированием на диодной матрице.
Результаты и обсуждение. Наилучший результат показала твердая дисперсная система на основе полимера Eudragit® E PO с размером частиц D90 менее 10 мкм. Увеличение концентрации дарунавира относительно кристаллической формы, соответствующей дарунавира этанолату, составило в средах растворения с рН 1,2; 4,5 и 6,8 соответственно 324, 2485 и 740 %.
Заключение. Способы получения твердых дисперсных систем, такие как удаление растворителя и экструзия горячего расплава, при одинаковом размере частиц не оказывают влияние на концентрацию АФС дарунавира в растворе в биологическом интервале рН при проведении теста «Растворение».
Введение. Адгезивные пластины, предназначенные для фиксации стомных мешков, а также защиты кожи перистомальной области стомированных пациентов, являются ключевым элементом калоприёмника или уроприёмника. Функциональность адгезивных пластин обеспечивается комплексом их технических характеристик и конструкционных особенностей, что делает выбор подходящих методов испытаний пластин важным аспектом в разработке, производстве и контроле качества этих медицинских изделий.
Текст. Для испытаний адгезивных пластин могут использоваться методы, как предусмотренные российскими и международными стандартами, так и не входящие в них. К предусмотренным стандартами методам испытаний относятся описание внешнего вида (размера), тестирование адгезионной прочности, исследование pH поверхности пластин, а также испытания на устойчивость к эрозии и абсорбционную способность пластин. Не включенные в стандарты на адгезивные пластины, но широко описанные в научной литературе и применяемые исследователями на практике методы включают в себя испытания некоторых адгезионных и механических характеристик, таких как липкость и прочность при сдвиге, а также испытания на растяжение или сгиб для характеристики прочностных и деформационных характеристик материала пластин. Также для адгезивных пластин могут применяться методы испытаний медицинских свойств, общие для всех медицинских изделий, контактирующих с кожей. Кроме того, показано, как адгезионные свойства пластин могут быть спрогнозированы на основе реологических свойств полимеров, входящих в состав адгезивного слоя, а также описаны факторы, важные при подборе материалов, моделирующих кожу в испытаниях in vitro.
Заключение. В обзоре представлена подробная характеристика методов, представляющих интерес для испытаний адгезивных пластин, в частности их общих принципов и условий проведения, а также методов, позволяющих прогнозировать адгезионные свойства пластин и определять связь между испытаниями адгезии in vivo и in vitro. Ряд описанных методов представляет интерес для включения в нормативную документацию на испытания адгезивных пластин при условии их унификации и модификации с учетом особенностей изделия.
Введение. Состав полимерных композиций, являющихся основой большинства лекарственных форм, предназначенных для аппликации на кожу, в том числе трансдермальных пластырей, помимо биофармацевтических свойств лекарственного препарата, определяет также потребительские свойства лекарственной формы. Потребительские свойства, в свою очередь, имеют важное значение для пациента, в том числе обуславливая его приверженность не только к терапии, но и конкретному производителю. Адгезивные пластины калоприемников (уроприемников), служащие для крепления стомных мешков и защиты кожи перистомальной области, характеризуются совокупностью потребительских свойств, определяющих их качество, являются хорошей моделью для изучения влияния потребительских свойств на предпочтения пациента.
Цель. Разработка методики сравнительного анализа полимерных композиций адгезивных пластин на основе их потребительских свойств.
Материалы и методы. Для достижения цели исследования применялся комплекс методов, включающий в себя библиографический, аналитический, сравнительный, опросный и структурно-функциональный анализы. Для определения весовых коэффициентов различных потребительских характеристик адгезивных пластин был проведен опрос экспертов.
Результаты и обсуждение. Определены основные потребительские свойства адгезивных пластин, к которым отнесены: отсутствие остатков адгезива на коже после удаления, легкость удаления, время ношения, гибкость, простота использования, устойчивость к влаге и выделениям, комфорт использования, прилипание, прочность сцепления с кожей, предотвращение подтеканий и отсутствие перистомальных осложнений. На основании экспертной оценки определены весовые коэффициенты для каждого потребительского свойства, предложена методика сравнительной оценки адгезивных пластин калоприемников (уроприемников), которая может быть использована для сравнительного анализа адгезивных пластин различных производителей.
Заключение. Разработанная методика сравнительной оценки адгезивных пластин может быть использована в качестве основы при разработке подобной методики оценки апплицируемых на кожу лекарственных форм на основе их потребительских свойств.
МЕТОДЫ АНАЛИЗА ЛЕКАРСТВЕННЫХ СРЕДСТВ
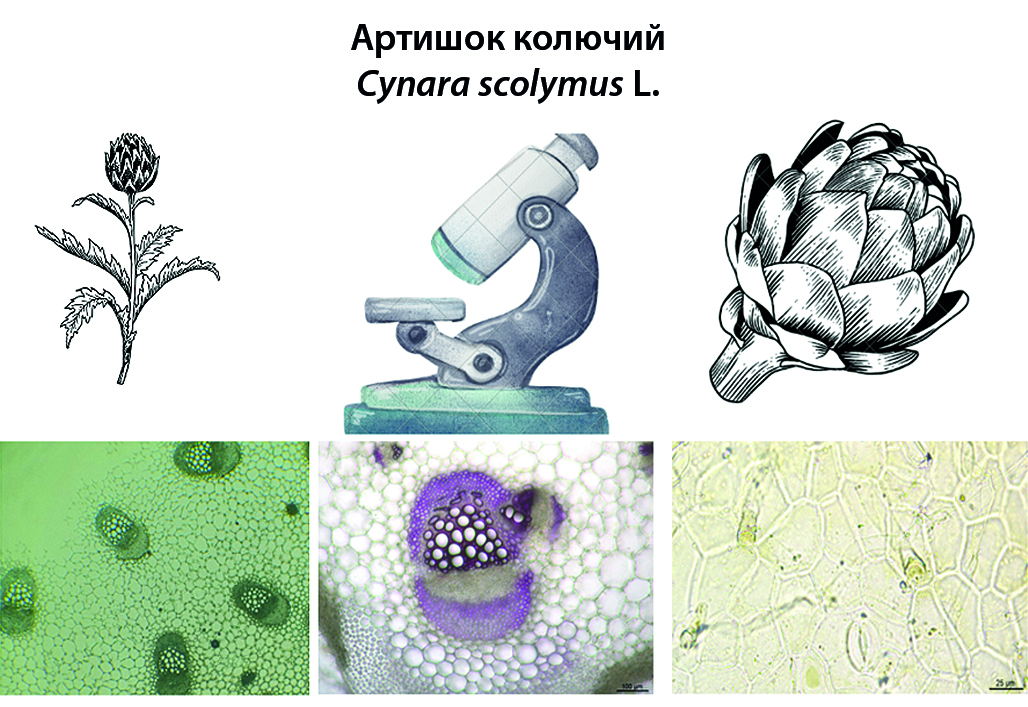
Введение. Артишок колючий – растение из семейства астровых, известное с IV века до н. э. как пищевое и лечебное средство. Это растение ценили древние египтяне, греки и римляне, которые использовали его как в пищу, так и в качестве лекарства. Артишок по-прежнему играет важную роль в питании человека, особенно в Средиземноморском регионе. Cynara scolymus L. демонстрирует широкий спектр фармакологической активности, его листья и цветки проявляют противовоспалительное, антиоксидантное, гепатопротекторное, желчегонное, антимикробное, гиполипидемическое свойства. Это снижает последующий риск развития таких состояний, как рак, диабет и сердечно-сосудистые заболевания. Поэтому данное растение потенциально может быть рассмотрено в качестве кандидата для разработки новых отечественных лекарственных препаратов. Характеристика лекарственного растительного сырья, включая морфолого-анатомические и фитохимические профили, является необходимой информацией для обеспечения качества сырья при разработке лекарств.
Цель. Данное исследование проведено с целью изучения макро- и микроморфологических признаков листьев артишока колючего для введения в медицинскую практику.
Материалы и методы. В качестве объекта исследования использовались высушенные листья артишока посевного (колючего) (Cynara scolymus L.), собранные в фазу цветения (июнь) в 2023 году в Ошской области Кыргызской Республики. Для обнаружения характерных внешних признаков листьев артишока колючего был проведен внешний осмотр аналитической пробы визуально (10 × ). Микроскопическое и гистохимическое исследование проводилось в соответствии с Государственной фармакопеей РФ XV изд., ОФС.1.5.3.0003 «Микроскопический и микрохимический анализ лекарственного растительного сырья и лекарственных средств растительного происхождения», с использованием микроскопа Leica DM1000 (Leica Microsystems CMS GmbH, Германия) с окуляром 10×/20 и объективами 10×/0,25, 40×/0,65, 100×/1,25. Вывод изображения на экран осуществлялся через программу Leica LAS v4.13 Software.
Результаты и обсуждение. В результате проведенных исследований установлены характерные морфолого-анатомические признаки листьев артишока колючего. Макроскопические признаки: листья продолговатой, широколанцетной формы, длиной 50–70 см и шириной 20–40 см, непарноперисторассеченные, край листа крупногородчатый; черешок мясистый, слабо выраженный, ребристый; жилкование перистое. На концах листовых пластинок имеются тонкие шипообразные выросты. Цвет верхней поверхности серовато-зеленый, нижней – серебристо-серый или беловойлочный. Запах при растирании слабый, вкус водного извлечения резко горький. Микроскопические признаки: верхний эпидермис состоит из изодиаметрических и полигональных многоугольных клеток с прямыми стенками, над жилками эпидермальные клетки – удлиненные. Устьица верхнего эпидермиса овальные, нижнего – более округлые. Устьица окружены 4–5 эпидермальными клетками. Трихомы листа артишока представлены простыми и головчатыми волосками. Простые волоски многоклеточные, имеют однорядное основание, состоящее из 2–8 коротких, иногда расширенных клеток. Оканчиваются простые волоски длинной, тонкой, извилистой тонкостенной клеткой. Головчатые волоски имеют короткую многоклеточную двурядную ножку и округлую одноклеточную головку, иногда с заметным желтоватым маслянистым содержимым. Поперечный срез главной жилки (без листовой пластинки) имеет полуокруглую форму со слегка вогнутой адаксиальной и выпукло-ребристой абаксиальной поверхностью. Проводящие пучки – коллатеральные, крупные – открытые, мелкие – закрытые. На эпидермисе жилки можно наблюдать простые и головчатые волоски.
Заключение. Впервые проведены исследования по изучению макро- и микроскопических признаков листьев артишока колючего, выращенного в условиях Кыргызской Республики, необходимые для установления подлинности и оценки качества сырья.
ДОКЛИНИЧЕСКИЕ И КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
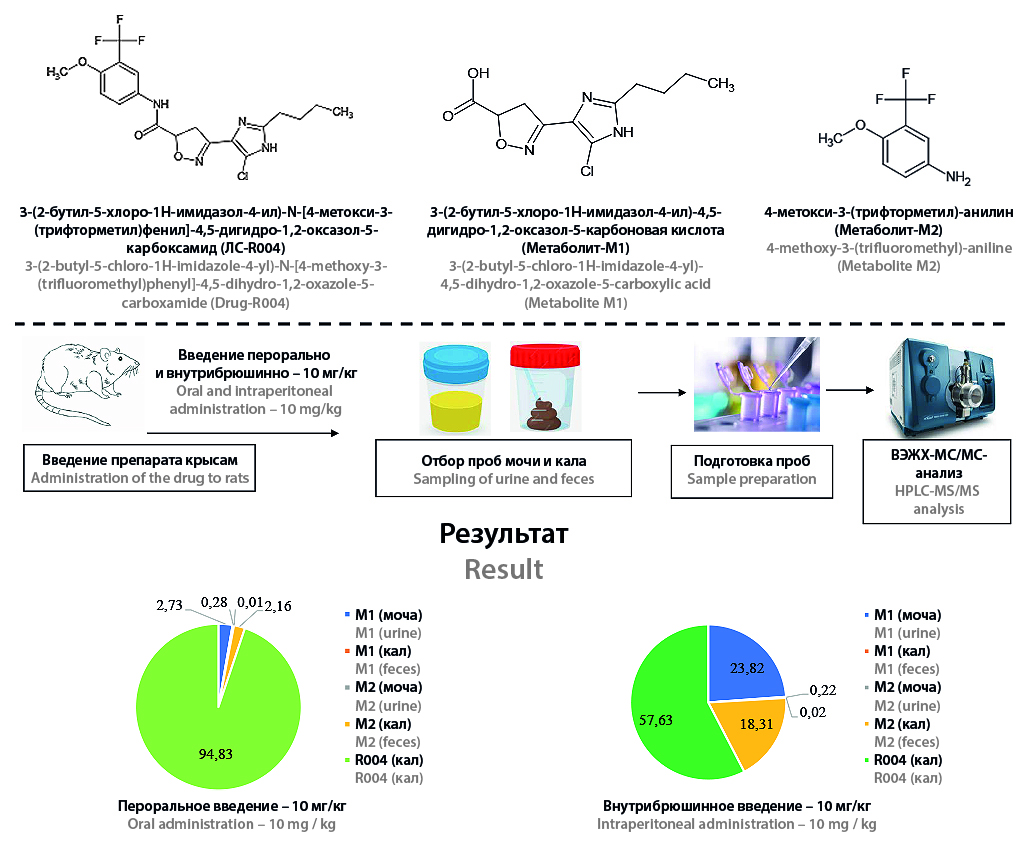
Введение. Новый селективный ингибитор PAR-2-рецепторов, 3-(2-бутил-5-хлоро-1Н-имидазол-4-ил)-N-[4-метокси-3-(трифторметил)фенил]-4,5-дигидро-1,2-оксазол-5-карбоксамид (R004), находится на стадии доклинического исследования. Изучение экскреции R004 и его метаболитов ранее не проводилось.
Цель. Изучение экскреции R004 и его метаболитов с мочой и калом после однократного перорального и внутрибрюшинного введения субстанции.
Материалы и методы. Исследование проводилось на 2 группах крыс линии Wistar по 6 особей. Первой группе субстанция R004 вводилась перорально в дозировке 10 мг/кг, второй группе – внутрибрюшинно в дозировке 10 мг/кг. Забор биоматериала проводился с помощью метаболических клеток. Пробы мочи отбирались до введения препарата и в промежутки 0–4, 4–8, 8–12, 12–24, 24–48, 48–72, 72–96, 96–120 ч после введения. Пробы фекалий отбирались до введения препарата и в промежутки 0–12, 12–24, 24–48, 48–72, 72–96, 96–120 ч. Анализ образцов проводился с помощью ВЭЖХ-МС/МС.
Результаты и обсуждение. Аналитический диапазон методики определения R004 и 4-метокси-3-(трифторметил)-анилина (М2) в моче составил 5–2000 нг/мл, а 3-(2-бутил-5-хлоро-1Н-имидазол-4-ил)-4,5-дигидро-1,2-оксазол-5-карбоновой кислоты (М1) – 100–40 000 нг/мл. В фекалиях концентрации R004 измеряли в диапазоне 0,5–500,0 мкг/г, M1 – 4–4000 нг/г, М2 – 40–40 000 нг/г. Основная часть лекарственного средства и метаболитов выводится в течение 48 ч после введения. Полная элиминация достигается спустя 96 ч. R004 экскретируется в неизменном виде только с фекалиями: 94,83 ± 0,78 % при пероральном введении и 57,63 ± 0,66 % при внутрибюшинном введении (М + m). Метаболит М1 выводится преимущественно ренальным путём, метаболит М2 – преимущественно через кишечник.
Заключение. Биоаналитические методики определения R004, М1 и M2 в моче и кале были успешно валидированы. Большая часть R004 экскретируется в неизменённом виде энтеральным путем. М1 выводится преимущественно с мочой, М2 – с фекалиями.
Введение. Адаптивный дизайн клинических исследований биоэквивалентности представляет собой более гибкий подход, позволяющий вносить изменения в протоколы в ходе исследования на основании накопленных данных. Для лекарственных препаратов – аналогов эндогенных соединений, к которым относится адеметионин, это может быть рациональным выбором, учитывая присутствие их эндогенных концентраций, возможные физиологические колебания и гомеостатические механизмы. Поскольку адеметионин включен в клинические рекомендации МЗ РФ по лечению различных заболеваний печени, большой интерес вызывает разработка воспроизведенных препаратов, что требует тщательного планирования клинических исследований.
Цель. Анализ разрешенных протоколов клинических исследований биоэквивалентности с адаптивным дизайном для ЛП – аналога эндогенного соединения адеметионина, таблеток, покрытых кишечнорастворимой оболочкой.
Материалы и методы. В базе данных разрешенных клинических исследований ГРЛС МЗ РФ был проведен поиск протоколов по ключевым словам «адаптивный дизайн», «биоэквивалентность» за период с 2023 по 2024 год.
Результаты и обсуждение. В статье проводится анализ 9 протоколов биоэквивалентности с адаптивным дизайном по Potvin C лекарственных препаратов – аналогов эндогенного соединения адеметионина, таблеток, покрытых кишечнорастворимой оболочкой. Первичными конечными точками являлись фармакокинетические параметры Cmax и AUC0–t. В качестве оцениваемого аналита изучался адеметионин. В 77,8 % протоколов планировалась оценка эндогенного фона адеметионина с последующей коррекцией фармакокинетических показателей. В изучаемых протоколах расчет размера выборки не проводился, так как значение коэффициента внутрииндивидуальной вариации (CVintra) Cmax и AUC0–t адеметионина в литературе не описано.
Заключение. Результаты анализа показали, что для разработки воспроизведенных препаратов адеметионина рациональным является корректно спланированное исследование биоэквивалентности с выбором адаптивного дизайна (до момента публикации в специализированной литературе значений CVintra адеметионина), с оценкой эндогенного фона. Учитывая модифицированную лекарственную форму, в клинической разработке данных препаратов необходимым является проведение исследований биоэквивалентности с приемом препаратов натощак и после приема пищи.
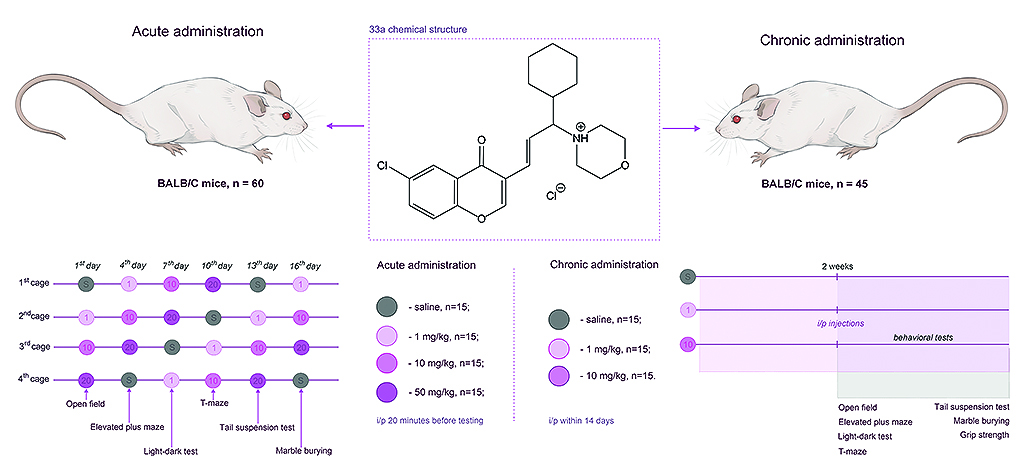
Введение. Поиск эффективных подходов к лечению тревожных расстройств, в частности разработка и изучение препаратов с анксиолитическим действием, в настоящее время является одной из наиболее актуальных задач нейробиологических исследований. Исследование изменения поведения рыб Danio rerio под действием новой группы веществ – хромонсодержащих аллилморфолинов – выявило их способность оказывать дозозависимую седацию, а одно из соединений ряда – (E)-4-[3-(6-хлор-4-оксо-4H-хромен-3-ил)-4-циклогексилаллил]морфолин-4-ия хлорид (33а), помимо седативного, оказывало также противотревожное действие в низких концентрациях. Danio rerio является эволюционно гораздо более древним видом, чем человек, и поэтому структурные и функциональные различия между рецепторами могут быть весьма существенны, что делает необходимым проведение оценки фармакологического профиля новых соединений на трансляционной модели, имеющей больше генетических сходств с человеком, а именно на грызунах.
Цель. В проведенном исследовании было изучено влияние 33а на тревожное поведение, когнитивные функции и силу хвата мышей линий BALB/c при остром и хроническом введении.
Материалы и методы. Оценку фармакологической активности проводили с помощью тестов «Открытое поле» (ОП), «Приподнятый крестообразный лабиринт» (ПКЛ), «Черно-белая камера» (ЧБК), «Т-образный лабиринт», «Закапывание шариков», «Подвешивание за хвост» и «Сила хвата» на мышах линии BALB/c (по 15 особей в каждой группе) при остром введении 33а в дозах 1, 10 и 50 мг/кг и двухнедельном введении доз 1 и 10 мг/кг.
Результаты и обсуждение. При остром введении вещество в дозе 50 мг/кг уменьшало число закопанных шариков, а в дозе 10 мг/кг при хроническом введении снижало латентное время первого перехода из темной камеры в белую в тесте ЧБК, что можно рассматривать как проявления анксиолитического действия. Однако в классическом тесте ПКЛ не было каких-либо статистически значимых эффектов, свидетельствующих об анксиолитическом действии 33а. В исследовании не было выявлено негативного влияния изучаемого вещества на пространственную память и силу хвата мышей, что может свидетельствовать об отсутствии у него нейротоксического действия.
Заключение. Полученные результаты подтвердили способность соединения 33а оказывать дозозависимое угнетение локомоторной активности, однако этот эффект был продемонстрирован не во всех тестах. Дальнейшее расширение спектра используемых поведенческих тестов, а также использование экспериментальных моделей может позволить выявить специфическую активность соединения 33а, а также других хромонсодержащих производных аллилморфолина.
Введение. Арония Мичурина (Aronia × mitschurinii A. K. Skvortsov & Maitul.) – культигенный вид, выведенный в конце XIX века в результате селекционных работ И. В. Мичурина по скрещиванию Aronia melanocarpa (Michx.) Elliott c отдаленно родственными видами из рода рябины (Sorbus). Плоды данного растения давно используются в народной и традиционной медицине, являясь прежде всего источником антоциановых соединений. Листья в настоящее время являются только побочным продуктом при заготовке плодов, однако могут быть использованы в качестве перспективного источника таких групп БАВ, как флавоноиды, дубильные вещества, лейкоантоцианы, что обуславливает возможность использования данного сырья для получения лекарственных растительных препаратов (ЛРП). Поэтому первичные скрининговые исследования in vitro по оценке токсичности и биостимулирующего действия извлечений из листьев аронии Мичурина для оценки перспективности и определения направлений последующих доклинических испытаний следует считать актуальными.
Цель. Целью исследования являлось изучение биостимулирующего и мембранопротекторного действия извлечений из листьев аронии Мичурина (на примере отвара) in vitro с использованием тест-системы инфузорий Parameсium caudatum в тесте «Функциональная нагрузка».
Материалы и методы. Листья аронии Мичурина для исследования заготавливали в различные периоды развития листовой пластинки (май, июнь, август и сентябрь 2023 г.) от растений, культивируемых на территории ФГБНУ «ФНЦ им. И. В. Мичурина» (г. Мичуринск, Тамбовская область). Для исследования готовили водные извлечения из исследуемого сырья по типу отвара в соответствии с ОФС.1.4.1.0018.15 «Настои и отвары» Государственной фармакопеи РФ для сырья, содержащего дубильные вещества. Для изучения биостимулирующего действия отвара листьев аронии Мичурина использовали in vitro тест-систему инфузорий Parameсium caudatum в стационарной фазе роста. Оценку биостимулирующего и мембранопротекторного действия изучаемого отвара проводили в тесте «Функциональная нагрузка» при повреждающем воздействии гипертонического раствора натрия хлорида.
Результаты и обсуждение. С использованием тест-системы инфузорий Parameсium caudatum в тесте «Функциональная нагрузка» установлено, что отвар листьев аронии Мичурина in vitro в разведении 1 : 10 во все сроки заготовки ЛРС снижает время выживаемости инфузорий при повреждающем воздействии гипертонического раствора натрия хлорида при инкубации в течение 24 ч максимально не менее чем на 43,5 % по сравнению с контрольной пробой, что, вероятно, свидетельствует о повышении проницаемости биологических мембран под влиянием дубильных веществ листьев и согласуется с их известным вяжущим и антибактериальным действием. Отвар листьев аронии Мичурина (при заготовке ЛРС в июне) in vitro в разведениях 1 : 1000 и 1 : 10 000, близких к диапазонам терапевтических доз, проявляет наибольшее биостимулирующее и мембранопротекторное действие, что подтверждается значительным достоверным повышением времени выживаемости инфузорий при повреждающем воздействии гипертонического раствора натрия хлорида максимально на 39,3 % по сравнению с контрольной пробой при инкубации в течение 24 ч, что, вероятно, связано с содержанием флавоноидов и лейкоантоцианов и согласуется с их известным капилляропротекторным и антиоксидантным действием.
Заключение. Отвар листьев аронии Мичурина (в разведении 1 : 1000 при заготовке ЛРС в июне) значительно достоверно повышает время выживаемости тест-системы инфузорий Parameсium caudatum при повреждающем воздействии раствора натрия хлорида в тесте «Функциональная нагрузка» максимально на 39,3 % по сравнению с контрольной пробой при инкубации в течение 24 ч, что свидетельствует о наличии биостимулирующего и мембранопротекторного действия.
Новости отрасли
2025-06-30
Ядерные технологии создают живые ткани: участник БИОПРОМА-2024 о новейших разработках «Росатома»
 | Выращенные в биофабрикаторе биосовместимые ткани и органы могут стать реальностью уже в обозримой перспективе. Ученые «Росатома» разработали биофабрикатор, который с помощью ультразвукового акустического поля позволяет создавать биосовместимые сосуды из клеток пациента. Исследования на животных уже подтвердили функциональность сосудистого эквивалента. Следующий этап — клинические испытания. |
2025-06-30
Bayer зарегистрировал в России препарат Эйлеа® в дозе 8 мг
 | Bayer зарегистрировал в России препарат Эйлеа® в дозе 8 мг (афлиберцепт 8 мг, раствор для инъекций 114,3 мг/мл) для лечения неоваскулярной («влажной») возрастной макулярной дегенерации (нВМД) и ухудшения зрения, вызванного диабетическим макулярным отеком (ДМО). |
2025-06-19
«Озон Фармацевтика» на ПМЭФ: дженерики как основа доступного здравоохранения и драйвер роста фармрынка России - Новости - Озон Фармацевтика
 | 18 июня в рамках сессии РБК «Здоровое общество» на Петербургском международном экономическом форуме (ПМЭФ) эксперты обсудили перспективы развития рынка дженериков в России. |
| Ещё новости |
ISSN 2658-5049 (Online)