ОТ РЕДАКЦИИ
В рамках мероприятия мы поговорим о жизненном цикле биотехнологических лекарственных средств, обсудим отдельные аспекты их разработки, исследований и производства.
Во второй части статьи приведены материалы по дальнейшему структурированию отечественной промышленности и образование трестов, разработке классификации химических производств и организации научно-технологического отдела ВСНХ (НТО). Показано особое отношение руководства страны к старым кадрам и организациям, обеспечивающим работу предприятий этой отрасли, а также заботу правительства о воспитании молодых отечественных химиков, выращенных в России. Особое место занимает работа по организации привлечения бывших владельцев заводов и фабрик к восстановлению их предприятий. По инициативе В. Н. Ипатьева была начата работа по организации концессионной комиссии при Госплане.
ФГУП «Федеральный центр по проектированию и развитию объектов ядерной медицины» ФМБА России, ведущий российский производитель терапевтических РФЛП, в этом году отмечает 55-летний юбилей. Предприятие стояло у истоков становления ядерной медицины в России, являлось и по настоящее время остается самым крупным производителем терапевтических РФЛП в нашей стране. История развития предприятия – это история развития ядерной медицины в России. В данной статье мы хотим представить анализ накопленного за годы работы предприятия производственного опыта – основные достижения и сложности, которые приходилось преодолевать. А также взаимосвязь истории функционирования предприятия с общими тенденциями развития ядерной медицины в России.
Размер частиц в вакцинах оказывает значительное влияние на их время полувыведения in vivo, а также на поглощение антигенпрезентирующими клетками. Предполагается, что на те же параметры влияет и поверхностный заряд частиц. В данном отчете для определения размера и дзета-потенциала частиц двух инактивированных противовирусных вакцин используются методы ДРС и ЭРС соответственно. Вакцина против клещевого энцефалита (КЭ) показывает мономодальное распределение размеров частиц в нижнем микрометрическом диапазоне, что соответствует ожидаемому размеру адъюванта на основе соли алюминия. Вакцина против гриппа на основе клеток, напротив, содержит как отдельные вирусы (примерно 30 нм), так и более крупные агрегаты (примерно 250 нм). Измерения дзета-потенциала показывают, что обе вакцины состоят из слабоанионных частиц. Интересно, что моделируемые нарушения холодовой цепи (тепловая обработка, замораживание-оттаивание) вызывают значительные изменения в распределении размеров частиц обеих вакцин.
МЕРОПРИЯТИЯ
17–18 марта в Новосибирске состоялась выставка оборудования, сырья, материалов и услуг для производства фармацевтических препаратов, парфюмерно-косметической продукции и БАДов.
С 19 по 22 апреля в МВЦ «Крокус Экспо» состоялась 20-я юбилейная Международная выставка лабораторного оборудования и химических реактивов «Аналитика Экспо 2022».
ПОИСК И РАЗРАБОТКА НОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
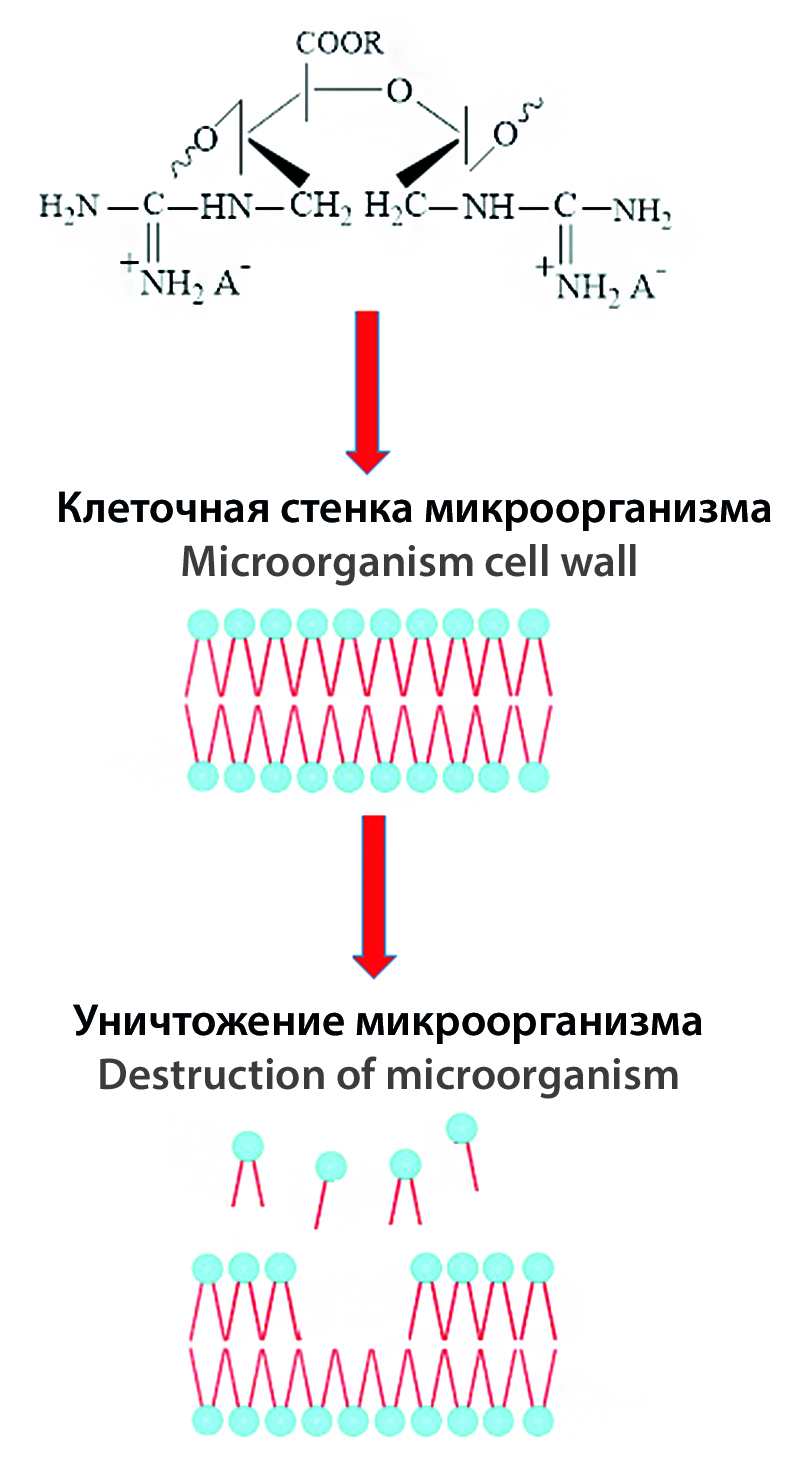
Введение. К настоящему времени практически отсутствуют данные о взаимосвязи между биологической активностью и структурными характеристиками антимикробных полимеров, синтезируемых путем химического присоединения гуанидиновых групп к макромолекулам полисахаридов. В связи с этим обстоятельством, представляется интересным осуществление химической модификации гуанидина природными полимерами в частности полиальдегидпектином и проведение сравнительных исследований антимикробной активности полученных образцов, имеющих различные физико-химические характеристики.
Цель. Синтез гуанидинсодержащих производных пектина и установление влияния структурных вариаций, полученных образцов на проявления антимикробных свойств.
Материалы и методы. Синтез гуанидинсодержащих производных пектина состоял из следующих стадий: периодатное окисление полисахарида, модификация гуанидина посредством полиальдегидпектина и химическое восстановление азометиновых связей. Количество гуанидина в полученных образцах вычислено ацидиметрическим титрованием, содержание азота (N, %) определено с помощью элементного анализатора марки Eura EA (Italy). Значения рКα синтезированных соединений найдены методом обратного титрования. Спектры поглощения были сняты на спектрофотометре «UV 1280» (Shimadzu, Japan), в диапазоне λ = 180–400 нм. ИК-спектры записывали на спектрометре Vector-22 в области длин волн 400–4000 см-1 в таблетках KBr (3 мг образца / 300 мг KBr). Молекулярно-массовые характеристики синтезированных производных, определяли методом высокоэффективной гельпроникающей хроматографии на жидкостном хроматографе Agilent 1260 Infiniti. Острая токсичность гуанидинсодержащих производных пектина определена методом Прозоровского. Сравнительная оценка антимикробной активности проводилась методом диффузии в агар.
Результаты и обсуждение. Варьируя степенью окисления полиальдегидпектина, синтезированы соединения, отличающиеся степенью замещения, содержанием гуанидина, молекулярной массой и значением рКα. Установлено, что выраженность антибактериальной и противогрибковой активности исследованных образцов зависит от степени замещения и природы противоиона. С увеличением количественного содержания гуанидиновых групп в макромолекулярной цепи пектина, возрастает противомикробное действие. Обнаружено, что замена низкомолекулярных Cl–, NO3– , F–, I– противоионов на карбоксилат-анионы приводит к резкому уменьшению антимикробных свойств. При пероральном введении синтезированных соединений мышам установлено, что все образцы относятся к разряду практически не токсичных веществ (V-й класс).
Заключение. Сравнительный анализ гуанидинсодержащих производных пектина с различными характеристиками показал, что выраженность антимикробного действия синтезированных соединений в отношении бактерий и грибов рода Candida зависит от количественного содержания катионных группировок и природы противоиона.
Введение. По оценке Всемирной организации здравоохранения, ежегодно от 1 до 4 миллионов человек заражаются холерой, и порядка 143 000 человек становятся жертвой этой инфекции. На данном этапе седьмой пандемии холеры ВОЗ и ее партнеры активно оценивают новые методы в лечении и профилактике холеры в дополнение к существующим традиционным мерам. Сегодня для лечения и профилактики ряда инфекционных заболеваний желудочно-кишечного тракта широко применяются энтеросорбенты. Ранее сообщалось о результатах конструирования специфического энтеросорбента, оказывающего нейтрализующее действие в отношении холерного энтеротоксина. Для контроля токсиннейтрализующей активности компонентов и готового экспериментального препарата применяется метод кожной пробы по Крейгу, который имеет существенные недостатки: длительность анализа, использование дорогостоящих биомоделей и т. д. Также важна этическая сторона методов in vivo, диктующая необходимость гуманизации экспериментов и замены млекопитающих менее развитыми живыми объектами, использованием физико-химических и иммунохимических систем.
Цель. Совершенствование методических подходов к определению активности полуфабриката и готового препарата энтеросорбента в непрямом дот-иммуноанализе (ДИА) с использованием неферментного диагностикума – наночастиц коллоидного золота.
Материалы и методы. Использовали антитоксические кроличьи иммуноглобулины и экспериментальные серии противохолерного иммуноэнтеросорбента. Определение токсиннейтрализующей активности проводили по Крейгу на взрослых кроликах. В непрямом ДИА использовали гидрозоль золота, сорбционно связанный со стафилококковым белком А и стабилизированный раствором ПЭГ-20000.
Результаты и обсуждение. В непрямом ДИА определены значения титров специфических антител в образцах компонентов препарата (от 1 : 6400 до 1 : 12800) и готового энтеросорбента (от 1 : 6400 до 1 : 25600). Специфичность теста подтверждена отрицательными результатами с нормальными кроличьими иммуноглобулинами. Проведен сравнительный анализ уровня токсиннейтрализующей активности антитоксических иммуноглобулинов и противохолерного энтеросорбента, определенных в кожной пробе по Крейгу и ДИА: коэффициент корреляции составил 0,93 и 0,97 соответственно.
Заключение. Разработанные методические подходы к проведению непрямого ДИА с диагностикумом на основе белка А S. аureus и наночастиц коллоидного золота могут быть использованы для определения уровня активности антитоксических иммуноглобулинов и экспериментального иммуноэнтеросорбента, а корреляция результатов тестов in vitro и in vivo позволяет рекомендовать непрямой ДИА на этапах контроля при изготовлении специфического противохолерного энтеросорбента.
Введение. В настоящее время активно ведутся исследования, направленные на поиск новых биообъектов как источников биологически активных веществ. Это необходимо для того, чтобы получить продуценты, которые будут выгодны в культивировании, поддержании их жизнедеятельности и получении на выходе достаточного количества и высокого качества целевых продуктов. Одним из таких источников могут быть микро- и макроводоросли.
Цель. Целью настоящего исследования является проведение фитохимического анализа для подтверждения наличия широкого спектра БАС, а также исследований по выбору оптимальных параметров экстрагирования биомассы хлореллы С-2019 с целью получения экстрактов с высоким содержанием БАС, обладающих антибактериальным действием (пигменты, флавоноиды).
Материалы и методы. Объектом исследования являлась воздушно-сухая биомасса штамма Chlorella vulgaris Beyerinck ИФР C-2019. Влажность, фракционный состав, зольность, экстрактивные вещества определяли по ГФ ХIV, 2018. В работе использованы спектрофотометрический, ГЖХ методы, а также метод капельного электрофореза.
Результаты и обсуждение. В результате фитохимического анализа были определены основные БАС биомассы хлореллы штамма C-2019. Доказано наличие белков (64 %), жирных кислот (7 %), фенольных соединений (1,56 %), пигментов (2,46 %), макро- и микроэлементов. Оптимальным соотношением сырье – экстрагент является 1 : 50. Повышение температуры и продолжительности экстрации увеличивало выход основных БАС.
Заключение. Определен фитохимический состав перспективного растительного сырья. Установлены оптимальные условия экстракции биомассы хлореллы при получении экстракта: соотношение сырье – экстрагент (1 : 50), экстрагент спирт этиловый 95%-й, температура экстракции 60–80 °С, трехкратная экстракция в течении 60, 60, 60 мин.
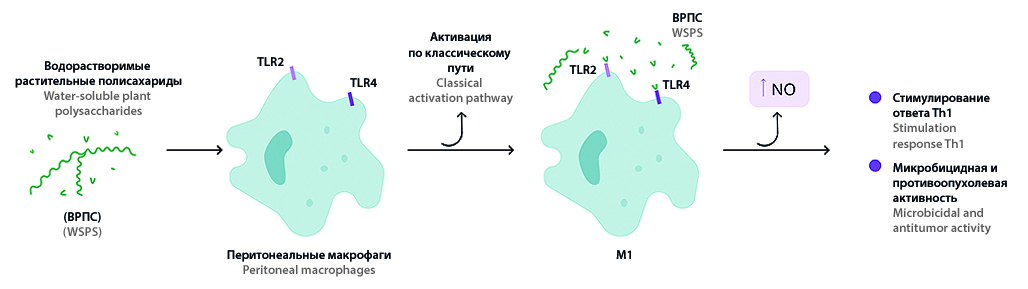
Введение. Со времен открытия молекулы оксида азота многочисленными исследованиями доказано, что он является одним из самых универсальных, многофункциональных медиаторов биологических реакций организма и участвует в формировании врожденного и специфического иммунитета, воспалительного процесса, защите от инфекционных патогенов. Знание эффектов NO важно не только для понимания формирования иммунного ответа, но и для разработки новых инструментов исследования и лечения различных заболеваний. Известно, что полисахариды высших растений широко применяются для активации про- и противовоспалительных реакций. Ранее проведенные исследования показали перспективность более детального изучения иммуномодулирующих свойств растительных полисахаридов рода Saussurea DC, возможных механизмов их иммуностимулирующего и противовоспалительного действия в зависимости от происхождения и экстракции.
Цель. Изучить влияние водорастворимых полисахаридов (ВРПС), выделенных из надземной части соссюреи иволистной (S. salicifolia (L.) DC.), соссюреи спорной (S. controversa DC.), соссюреи Фролова (S. frolovii Ledeb.) при различных условиях экстракции, на активность фермента
NO-синтазы и пролиферацию перитонеальных макрофагов.
Материалы и методы. Использовались химические методы выделения водорастворимых полисахаридов, культуральные и биохимические методы оценки биологической активности.
Результаты и обсуждение. Водорастворимые полисахариды (ВРПС), выделенные различным способом из надземной части соссюреи иволистной (S. salicifolia (L.) DC.), соссюреи спорной (S. controversa DС.), соссюреи Фролова (S. frolovii Ledeb.), обладают способностью усиливать продукцию нитритов антигенпрезентирующими клетками на уровне стандартного активатора макрофагов липолисахарида. NO-стимулирующие свойства ВРПС, полученных из S. controversa и S. frolovii экстрагентом в кислой среде, свободны от примеси эндотоксина. В результате экстракции образцов ВРПС с использованием нейтрального и щелочного экстрагента из всех изученных растений, а также кислого экстрагента из соссюреи спорной, примесь эндотоксина в образцах обнаруживалась. Все исследуемые образцы, в независимости от условий экстракции не обладали цитотоксическими свойствами.
Заключение. Экспериментально показано, что способ экстракции водорастворимых полисахаридов не влияет на цитотоксические свойства, но влияет на наличие/отсутствие примеси эндотокисна в образцах. Установлено, что образцы ВРПС, выделенные из растений рода Соссюреи при помощи кислого экстрагента, не обладают цитотоксическими свойствами и не содержат примеси эндотоксина, а также способствуют значительному усилению продукции оксида азота макрофагами и могут быть использованы для детального изучения иммуномодулирующих свойств и дальнейшей разработки на их основе новых приемов лечения различных заболеваний, требующих коррекции и регуляции функциональной активности иммунных клеток, включая макрофаги.
Введение. Возникновение новых штаммов микроорганизмов, обладающих множественной лекарственной устойчивостью (МЛУ), является одной из самых актуальных проблем современной медицины. В настоящее время для борьбы с МЛУ предпринимаются активные попытки получения новых биологически активных веществ природного (микробного, растительного, животного) происхождения. Ранее, коллективом авторов было выделено 32 индивидуальных соединения из надземной части Iris laclea Pall., листьев Rubus chameamorus L., побегов Empetrum nigrum L., травы Ononis arvensis L. и травы Solidago canadensis L. и еще 2 соединения синтезированы по ранее опубликованным методикам. Исследование противомикробной активности соединений полифенольной природы представляет собой актуальную задачу для поиска потенциальных средств для борьбы с МЛУ.
Цель. Изучение противомикробной активности индивидуальных выделенных и синтезированных веществ, в отношении Staphylococcus aureus, Escherichia coli и Candida albicans.
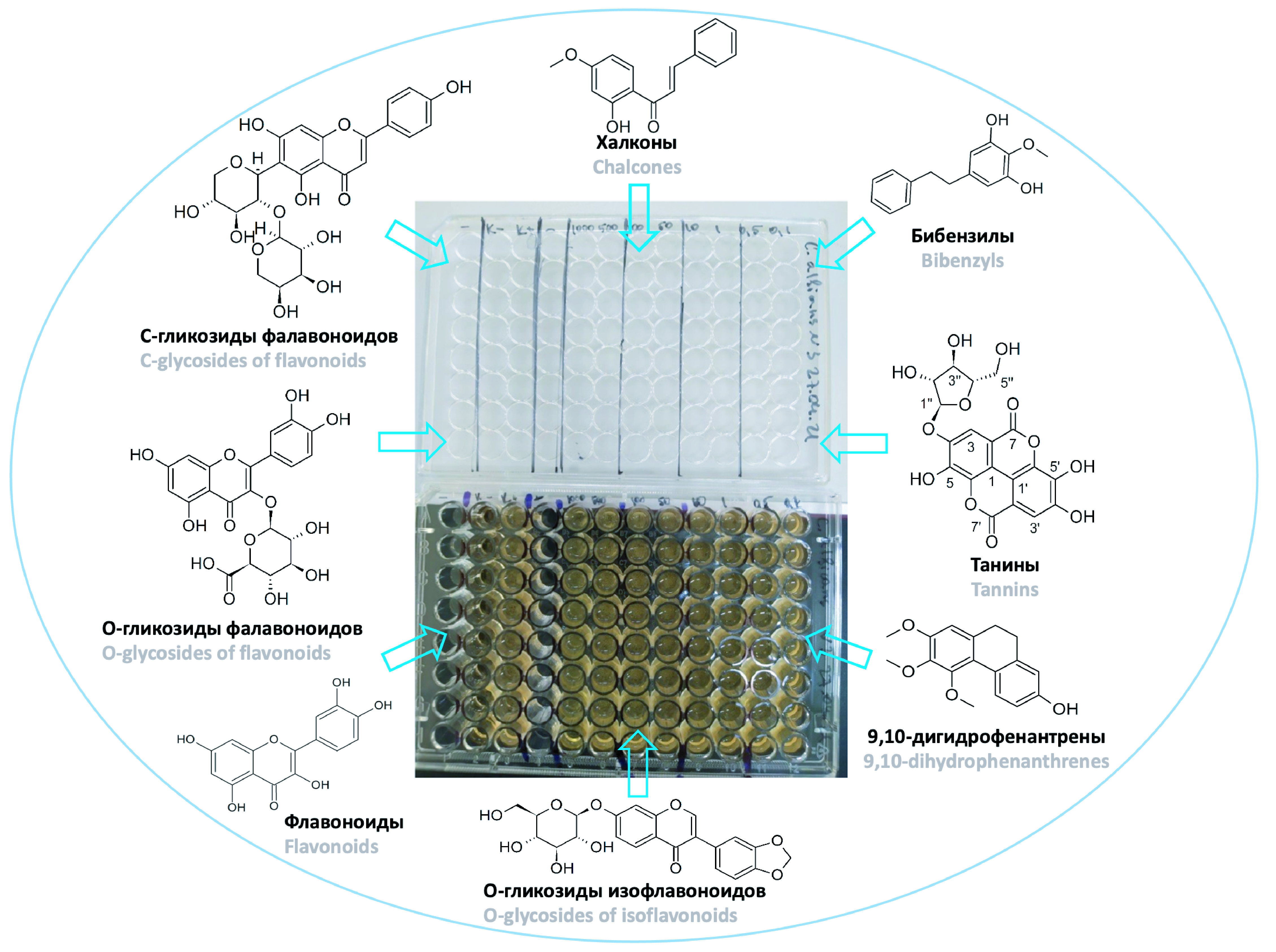
Материалы и методы. Для изучения противомикробной активности использовали субстанции 34 соединений, получены в результате предыдущих исследований, структура которых была установлена с использованием методов ЯМР-спектроскопии и масс-спектрометрии высокого разрешения. Противогрибковую и антибактериальную активность соединений определяли микрометодом двукратных серийных разведений в жидкой питательной среде в 96-луночных планшетах в двух повторах. Скрининг противомикробной активности осуществляли в отношении референтных (типовых) штаммов Staphylococcus aureus ATCC 6538-P, Escherichia coli ATCC 25922, Candida albicans NCTC 885-653.
Результаты и обсуждение. В группе флавоноидов, О- и С-гликозидов противогрибковая активность всех исследованных соединений значительно не отличалась, но следует отметить незначительно более выраженную антибактериальную активность С-гликозидов апигенина и О-гликозидов изофлавоноидов в сравнении с О-гликозидами флавонолов. Наибольшую противомикробную активность среди группы халконов проявили непосредственно сами халконы – халкон, 2’,4’-дигидроксихалкон и 2’-гидрокси-4’-метоксихалкон. Среди дигидрохалконов наибольшая противомикробная активность была выявлена у 2’,4’-дигидроксидигидрохалкона, которая по своей величине сравнима с противомикробной активностью непосредственно самих халконов. Интересная особенность дигидрохалконов заключается в том, что метилирование фенольных гидроксильных групп в 2’ и 4’ положениях изменяет противомикробную активность в сторону ее уменьшения. Противомикробная активность 9,10-дигидрофенантренов, как и в случае дигидрохалконов, имела зависимость от количества метокси-групп в молекуле. Наименьшие значения МИК проявил 4,7-дигидрокси-2,3-диметокси-9,10-дигидрофенантрен, содержащий всего две метоксигруппы. Для бибензилов наблюдалось обратная зависимость антимикробной активности от количества метоксигрупп – наилучшую активность среди бибензилов против исследуемых штаммов проявил 1-(3-гидроксифенил)-2-(3-гидрокси-4,5-диметоксифенил)этан, содержащий в своей структуре две метоксигруппы.
Заключение. Полифенольные вторичные метаболиты растительного происхождения, относящиеся к исследуемым группам: флавоноиды и О-, С-гликозиды, халконы, 9,10-дигидрофенантрены и бибензилы не проявили значимую противомикробную активность по отношению к изученным штаммам микроорганизмов – S. aureus (6538Р АТСС), E. coli (25922 АТСС) и С. albicans (885-653 NCTC). Не смотря на этот факт, была выявлена определенная вариация противомикробной активности в зависимости от структуры исследуемого вещества.
ФАРМАЦЕВТИЧЕСКАЯ ТЕХНОЛОГИЯ
Введение. Инфекционные отиты наружного и среднего уха способны вызывать потерю слуха, что существенно снижает качество жизни пациентов. Основными возбудителями острого бактериального отита являются Pseudomonas aeruginosa и Staphylococcus aureus. Статья посвящена разработке и изучению новой лекарственной формы для лечения инфекционных отитов, содержащей бактериофаги, лизирующие бактериальные штаммы Pseudomonas aeruginosa. Препараты бактериофагов могут быть альтернативой препаратам антибиотиков местного действия, использующихся в оториноларингологической практике по всему миру. В качестве перспективной лекарственной формы для инстилляции в ушной проход рассматривались ушные капли.
Цель. Целью работы является разработка лекарственной формы бактериофагов Pseudomonas aeruginosa для местного лечения инфекционных отитов.
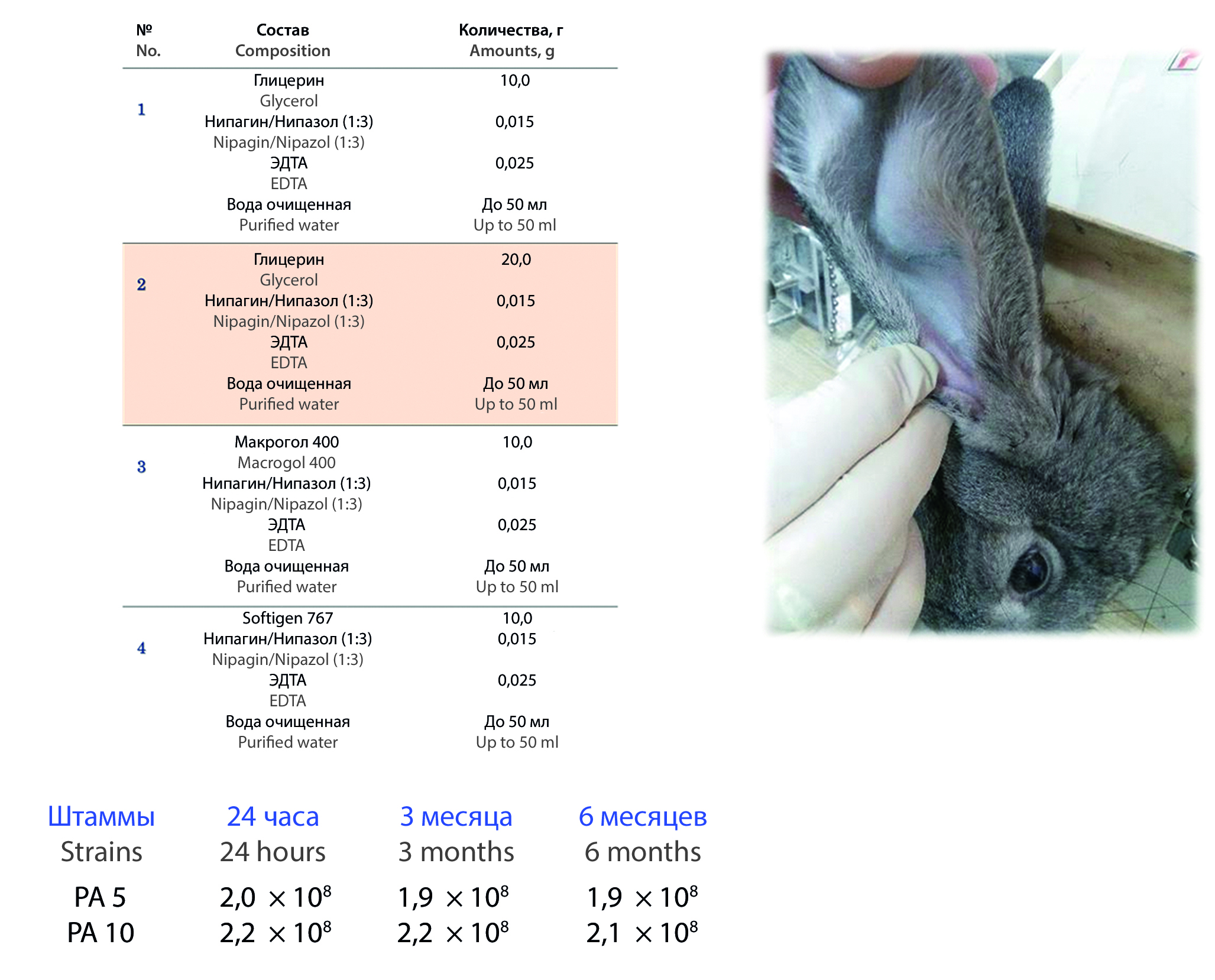
Материалы и методы. Действующими веществами разрабатываемого препарата являются бактериофаги, лизирующие бактериальные штаммы Pseudomonas aeruginosa: РА5 и РА10, полученные методом выращивания на плотной питательной среде в матрасах с последующей стерилизующей фильтрацией через мембранный фильтр (0,22 мкм) и освобождением от эндотоксина на хроматографической колонке. Для получения экспериментальных составов использовались эксципиенты, не вызывающие падения титра бактериофагов – растворитель вода очищенная, модификаторы вязкости глицерин (ООО ТД «ХИММЕД», Россия) и смесь макрогола 6 и глицерил каприлокапрата марки Softigen® 767 (Cremer, Германия), антиоксидант этилендиаминтетрауксусная кислота (ЭДТА), консерванты нипагин и нипазол. Полученные образцы стандартизовали по фармакопейным показателям, рекомендуемым для лекарственной формы капли: плотность, рН, вязкость. Для всех экспериментальных составов изучали стабильность титра бактериофагов по методу Грациа в течение 12 месяцев, также исследовали местораздражающее и системное действие на пяти кроликах самцах породы шиншилла.
Результаты и обсуждение. В результате проведенных исследований получено четыре экспериментальных состава ушных капель с коктейлем бактериофагов РА5 и РА10. Оптимальным технологическими характеристиками обладал состав, содержащий глицерин в качестве модификатора вязкости в концентрации 10,0 %. Для этого образца установлены стабильность титра бактериофагов РА5 и РА10, отсутствие местнораздражающего и системного действия.
Заключение. По итогам проведенных исследований лекарственная форма может быть рекомендована к проведению доклинических исследований, а после проведения дополнительных испытаний на других бактериофагах – для применения в персонализированной фаготерапии.
Введение. Ивермектин – противопаразитарный препарат, который широко зарекомендовал себя в ветеринарии. Паразитарные болезни сельскохозяйственных животных причиняют большой экономический ущерб и несут опасность заражения человека. Для эффективной борьбы с ними практический интерес представляют пролонгированные лекарственные формы ивермектина. Первым шагом в создании такого препарата стало получение и изучение полимерных микрочастиц поликапролактона с инкапсулирвоанным ивермектином.
Цель. Получение полимерных микрочастиц поликапролактона с инкапсулированным ивермектином с использованием проточной установки непрерывного действия.
Материалы и методы. Объектом исследования являлись микрочастицы поликапролактона с инкапсулированным ивермектином, полученные на проточной установке непрерывного действия. Определение среднего размера частиц и их распределение по размеру проводили методом лазерной дифракции. С помощью микроскопии проводили визуальную оценку формы и размеров микрочастиц. Количественное определение ивермектина определяли с помощью УФ-спектрофотомерии.
Результаты и обсуждение. Проведенные исследования позволили получить полимерные микрочастицы поликапролактона с инкапсулированным ивермектином, которые имели средний размером 126,63 ± 42,67 мкм и содержали 32,73–62,00 % ивермектина. Суспензии, приготовленные из полученных микрочастиц, без заметного сопротивления проходили через инъекционную иглу 20G, что свидетельствует о возможности их использования в качестве основы инъекционного препарата.
Заключение. В рамках проведенного исследования были получены результаты, которые подтверждают возможность применения проточного диспергирования с использованием разработанной нами установки для получения микрочастиц поликапролактона с инкапсулированным ивермектином, которые пригодны для инъекционного введения. Таким образом, полученные результаты позволяют продолжить исследования микрочастиц и создание препарата на их основе.
Введение. Многие новые фармацевтические субстанции (ФС) обладают низкой растворимостью, что может негативно сказаться на биодоступности и, как следствие, на терапевтической эффективности. К таким субстанциям относятся следующие антиретровирусные ФС: ритонавир, эфавиренз, этравирин. Для увеличения растворения ФС применяют различные подходы, например, получение твердых дисперсных систем (ТДС), носителями ФС в которых являются полимеры или использование ПАВ. Однако методы, используемые для получения ТДС, имеют ряд недостатков: использование высоких температур, органических растворителей и дорогостоящего оборудования. В свою очередь, ПАВ влияют на работу внутренних органов, обладают раздражающим действием. В качестве альтернативы данным подходам могут быть использованы фармацевтические приемлемые полимеры, более безопасные в сравнении с низкомолекулярными ПАВ, но тем не менее, обладающие поверхностно активными свойствами.
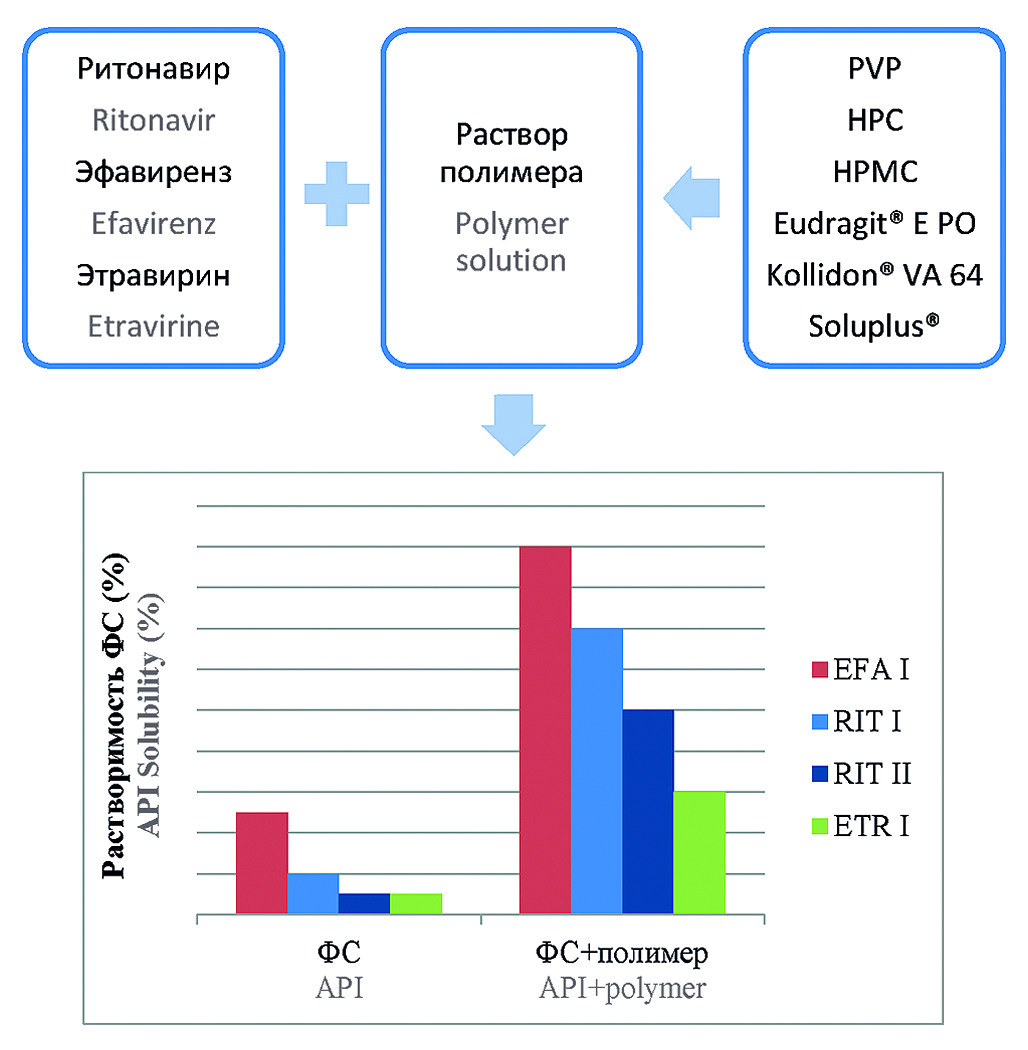
Цель. Изучение влияния полимеров фармацевтического качества на растворение практически нерастворимых антиретровирусных ФС: ритонавира, эфавиренза, этравирина.
Материалы и методы. Фармацевтические субстанции: эфавиренз форма І (ООО «АМЕДАРТ», Россия, серия 010520); эфавиренз стандартный образец (USP № R09740); ритонавир форма І (ООО «АМЕДАРТ», Россия, серия 010320); ритонавир форма ІІ (ООО «АМЕДАРТ», Россия, серия 010320); ритонавир стандартный образец (USP № H0M427); этравирин форма І (ООО «АМЕДАРТ», Россия, серия 010720); этравирин стандартный образец (MSN, Индия, серия ETV/A312/6/01). Растворение субстанций в растворах полимеров изучали на аппарате «Лопастная мешалка» в условиях, рекомендуемых FDA для соответствующих лекарственных препаратов.
Результаты и обсуждение. Установлены факторы влияния: вид полимера, концентрация раствора полимера и рН среды. Характер влияния не однозначен: возможно как увеличение растворения субстанции, так и снижение. Некоторые полимеры, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, Eudragit® E PO, способны существенно увеличить растворение субстанций, в то время как поливинилпирролидон способен в ряде случаев их заблокировать. Наибольшая степень увеличения растворения ритонавира, эфавиренза и этравирина установлена в растворах Eudragit® E PO.
Заключение. Результаты исследования показали целесообразность определения биодоступности лекарственных форм практически нерастворимых фармацевтических субстанций при включении полимерных вспомогательных веществ в их рецептуры.
Введение. Использование комбинированного растительного экстракта цветков ромашки, календулы и травы тысячелистника (патент RU 1 561 262 С) может быть эффективно против различных штаммов микроорганизмов, в том числе вызывающих воспалительные заболевания полости рта. В статье представлены результаты сравнительного фармацевтико-технологического исследования адсорбированного жидкого растительного экстракта на сорбентах различной природы, для последующего введения в состав таблеток для рассасывания.
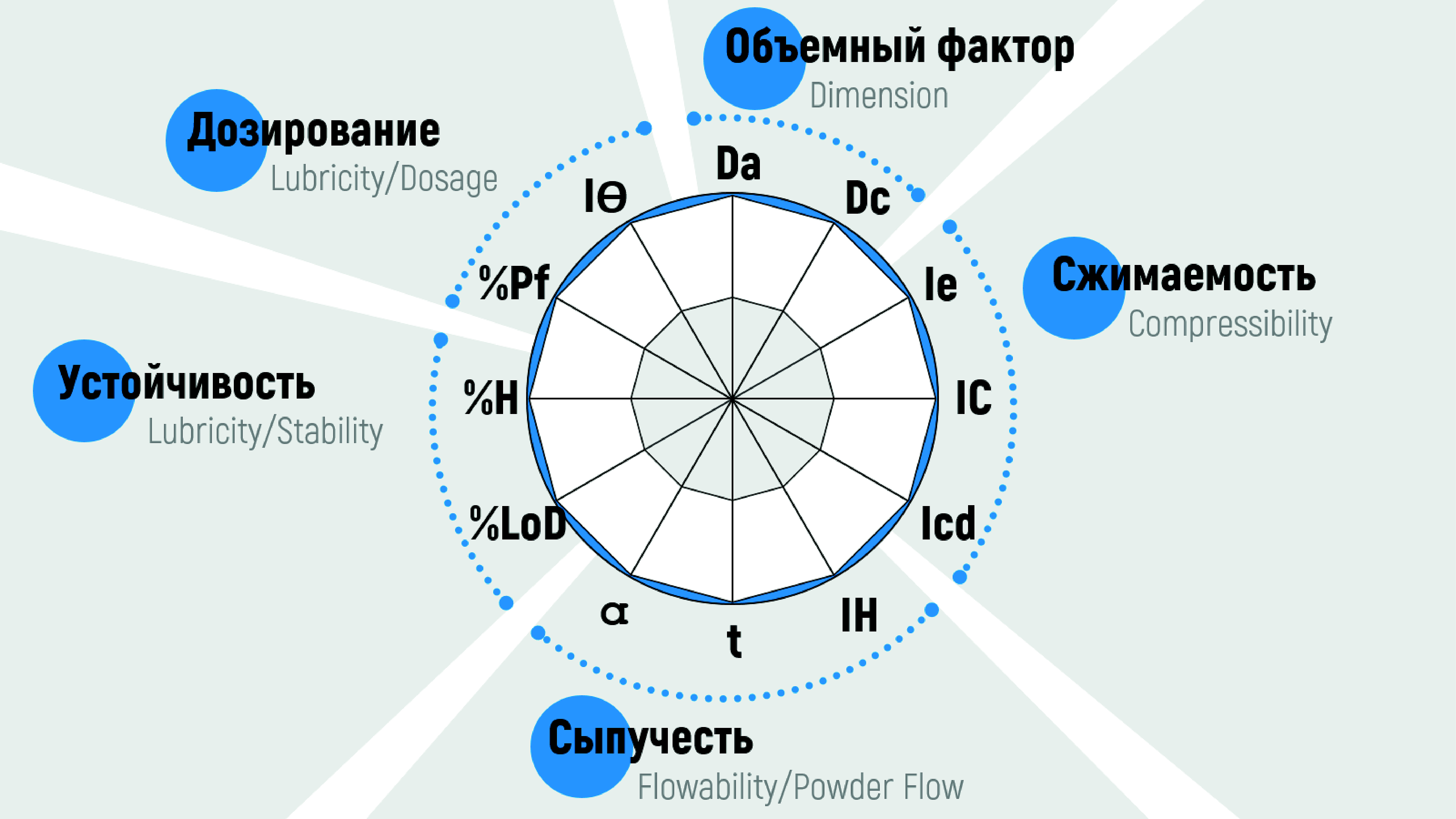
Цель. Выбрать с помощью метода SeDeM expert system оптимальный сорбент для комбинированного жидкого растительного экстракта цветков ромашки, календулы и травы тысячелистника, обеспечивающий его пригодность для прямого прессования.
Материалы и методы. В качестве активной фармацевтической субстанции использовали адсорбированный на органических (микрокристаллические целлюлозы различных марок) и неорганических (кремния диоксиде коллоидном различных марок) сорбентах жидкий комбинированный растительный экстракт противовоспалительного и антибактериального действия цветков ромашки аптечной, цветков календулы лекарственной и травы тысячелистника обыкновенного. Фармацевтико-технологический анализ включал в себя изучение таких технологических параметров, как: насыпная плотность до уплотнения (Da = m/Vа), насыпная плотность после уплотнения (Dc = m/Vc), межчастичная пористость (Ie = (Dc – Da)/(Dc · Da)), индекс Карра (IC = (Dc – Da)/(Dc · 100)), прессуемость (Icd), индекс Хауснера (IH = Dc/Da), угол естественного откоса (Tgα = h/r), сыпучесть (t), влажность (%LoD), гигроскопичность (%H), содержание частиц менее 50 мкм (%Pf), индекс гомогенности (IΘ = Fm/100 + ∆Fmna).
Результаты и обсуждение. Провели комплексное фармацевтико-технологическое исследование сорбентов жидкого растительного экстракта до и после адсорбции, результаты которого обработали и представили методом SeDeM expert system, который позволяет охарактеризовать сыпучие материалы с позиции пригодности для прямого прессования, установить факторы, которые первостепенно требуют корректировки путём введения вспомогательных веществ. Установили, что адсорбция экстракта положительного влияет на объемный фактор (D = (VDa + VDc)/2) всех изученных сорбентов, что может быть связано с изменением фракционного состава вследствие агрегации мелких частиц при адсорбции и деструкции крупных при просеивании готовых смесей через сито с диаметром ячеек 200 мкм (рекомендованный размер нерастворимых частиц для применения в полости рта). Отрицательное влияние на фактор устойчивость (S = (V%LoD + V%H)/2) зафиксировали также для всех образцов, вне зависимости от их природы, что вероятно объясняется остаточной влагой после высушивания и высокой гигроскопичностью адсорбированных комплексов растительных биологически активных веществ. Изменения фактора сжимаемость (C = (VIe + VIC + VIcd)/3), фактора сыпучести (F = (VIH + Vα + Vt)/3) и фактора дозирование (Dos = (V%Pf +VIΘ)/2) носят индивидуальный характер.
Заключение. В результате проведенных исследований, для введения комбинированного жидкого растительного экстракта цветков ромашки аптечной, цветков календулы лекарственной и травы тысячелистника обыкновенного в состав таблеток, предназначенных для рассасывания, можно рекомендовать неорганический сорбент Aeroperl 300 и органический сорбент Pharmacel 112.
Введение. Антибиотик пептидной природы грамицидин С находит широкое применение протяжении более чем 70 лет. Грамицидин С выпускается в форме таблеток, которые имеют низкую дозировку, что обуславливает риск отклонения по показателю «Однородность дозирования». Содержание в таблетках лактозы и сахарозы, ограничивает применение препарата пациентами с непереносимостью данных компонентов. В качестве альтернативы предлагается образование комплексов включения грамицидина С с β-циклодекстрином.
Цель. Исследовать влияние способов получения комплексов включения грамицидина С и β-циклодекстрина на их технологические показатели
Материалы и методы. Получение комплекса включения грамицидина С и β-циклодекстрина проводили с применением методов сухого смешивания, затирания в пасте, соосаждения, комплексообразования в псевдоожиженном слое. Подтверждение образования комплекса проводили, используя 1H ЯМР-спектроскопию, дифференциальную сканирующую калориметрию и термогравиметрию. Морфологию определяли с применением методов сканирующей электронной микроскопии, динамического рассеяния света. Сыпучесть, угол откоса, насыпную плотность полученных порошков определяли с применением методик, указанных в Государственной фармакопее РФ XIV издания.
Результаты и обсуждение. В ходе работы получен ряд комплексов грамицидина С и β-циклодекстрина с использованием различных способов. Термограммы комплексов включения демонстрируют значительное изменение пика в области, соответствующей фазовому переходу веществ, что явно свидетельствует о наличии взаимодействия между компонентами комплекса включения. Результаты 1Н ЯМР-спектроскопии позволили сделать вывод о комплексообразовании по аминогруппе L-орнитина в молекуле грамицидина С. При исследовании технологических свойств комплексов включения грамицидина С и β-циклодекстрина, установлена значительная вариабельность их технологических параметров, что связано, в том числе, с морфологией частиц. Комплексы, полученные с использованием методов соосаждения и комплексообразования в псевдоожиженном слое, могут быть использованы в производстве таблетированных лекарственных форм грамицидина С по технологии прямого прессования.
Заключение. В рамках настоящего исследования установлено, что образование комплекса включения грамицидина С и β-циклодекстрина проходит по аминогруппе L-орнитина в молекуле грамицидина С. Обнаружены существенные различия размеров и формы частиц, что сказывается на значениях технологических параметров комплексов включения, получаемых с использованием различных подходов. Полученные результаты могут быть использованы при разработке новых буккальных форм грамицидина С, обладающих меньшей вероятностью несоответствия по показателю «Однородность дозирования» и исключающих содержание лактозы и сахарозы.
Введение. Кишечнорастворимые покрытия обладают широким спектром функций: от защиты АФИ от неблагоприятного воздействия кислой среды желудка до направленной доставки в определенные отделы кишечника с целью увеличения эффективности ЛП. При разработке таких ЛФ особое внимание уделяют типу пленкообразующего полимера в составе покрытия, его растворимости и способности выдерживать прохождение через желудок.
Цель. Разработка таблеток на основе 4,4’-(пропандиамидо)дибензоата натрия, покрытых кишечнорастворимой оболочкой.
Материалы и методы. Объектами исследования являлись таблетки-ядра 4,4’-(пропандиамидо)дибензоата натрия 60 мг и композиции для кишечнорастворимых покрытий. Равномерность распределения покрытий по таблеткам определяли по методике, разработанной на кафедре технологии ФГБОУ ВО СПХФУ Минздрава России, на основании уравнения Фоккера – Планка. Кинетику растворения таблеток, покрытых кишечнорастворимой оболочкой, изучали с использованием тестера растворения таблеток Erweka DT 626 (ERWEKA GmbH, Германия). Количество перешедшего в среду растворения вещества определяли при помощи спектрофотометра СФ-2000 (ООО «ОКБ Спектр», Россия).
Результаты и обсуждение. Установлено, что все исследуемые покрытия распределяются по таблеткам равномерно. При изучении кинетики растворения таблеток установлено, что все покрытия обладают устойчивостью к воздействию кислой среды (0,1 М раствор хлористоводородной кислоты), однако в фосфатном буферном растворе наиболее высокая скорость высвобождения вещества из таблеток достигается с применением покрытия на основе сополимера метакриловой кислоты и этилакрилата типа В.
Заключение. Разработаны таблетки на основе 4,4’-(пропандиамидо)дибензоата натрия, покрытые кишечнорастворимой оболочкой AquaPolish® P white 712.06E.
Введение. В последние десятилетия в лечении онкологии прогрессирует роль рентгенэндоваскулярных методов. Стало возможным выполнять эмболизацию не только для остановки кровотечения из опухоли, но и с целью адресной доставки химиопрепаратов. Однако особый интерес представляет разработка новых комбинированных препаратов, сочетающих цитостатическое действие, эмболизацию кровеносных сосудов, питающих опухоль, и обезболивание.
Цель. Цель исследования – разработка состава и технологии комбинированного лекарственного средства для парентерального введения, включающего лиофилизированные полимерные микросферы, насыщенные доксорубицина гидрохлоридом, и инъекционный раствор коменовой кислоты.
Материалы и методы. Исследование сорбции коменовой кислоты полимерными микросферами осуществляли с использованием метода ВЭЖХ. Анализ внешнего вида полимерных микросфер и получение их фотографических изображений проводили методом микроскопии при помощи микроскопа с цифровой камерой.
Результаты и обсуждение. Проведенное исследование позволило определить, что коменовая кислота, в отличие от доксорубицина гидрохлорида, практически не сорбируется полимерными микросферами, что обосновывает целесообразность включения раствора коменовой кислоты в состав готовой лекарственной формы в виде отдельного инъекционного раствора. Установлено, что при получении лиофилизированных полимерных микросфер, насыщенных доксорубицина гидрохлоридом, необходимо использовать в качестве растворителя лиофилизата доксорубицина гидрохлорида воду для инъекций. Разработано комбинированное лекарственное средство, предназначенное для применения в области рентгенохирургии, содержащее: флакон с лиофилизатом полимерных микросфер, насыщенных доксорубицина гидрохлоридом в соотношении 1 : 2, предназначенных для проведения химиоэмболизации; ампулу с раствором, содержащим 20 мг/мл коменовой кислоты, предназначенным для внутривенного введения с целью купирования болей.
Заключение. В результате исследования изучена возможность сорбции коменовой кислоты полимерными микросферами. Разработана технология получения насыщенных доксорубицина гидрохлоридом полимерных микросфер. Разработано комбинированное лекарственное средство, предназначенное для применения в области рентгенохирургии.
Введение. Дигидрокверцетин – флавоноид, обладающий широким спектром фармакологической активности. Установлен его позитивный терапевтический профиль при хронической венозной недостаточности, хронической обструктивной болезни легких и бронхиальной астме, для предупреждения инсульта. Его использование приводит к улучшению течения атеросклероза и болезни Альцгеймера. Кроме того, для него характерны радиопротекторное, противовоспалительное, противоаллергическое, репаративное, гепатопротекторное действия. В настоящее время лекарственных препаратов, содержащих дигидрокверцетин, на отечественном фармацевтическом рынке нет. Однако выраженный терапевтический потенциал дигидрокверцетина экономическая и технологическая доступность его субстанции свидетельствуют об актуальности разработки лекарственных форм на основе настоящей молекулы.
Цель. Разработка оптимального состава и технологии таблеток на основе дигидрокверцетина и оценка их физико-химических свойств, общетоксического действия и безопасности.
Материалы и методы. Таблетки получали методом прямого прессования на лабораторном роторном прессе XS press (Robert Bosch Gmbh, Германия). Сыпучесть и насыпную плотность порошков определяли на приборе ERWEKA GT (ERWEKA GmbH, Германия). Испытания таблеток на прочность и геометрические размеры проводили на тестере SOTAX HT1 (SOTAX AG, Швейцария), истираемость таблеток определяли на тестере SOTAX F2 (SOTAX AG, Швейцария), распадаемость определяли на тестере DISI-A Touch (CHARLES ISCHI AG, Швейцария). Использована субстанция дигидрокверцетина компании ООО «Химия Древесины». В качестве вспомогательных веществ использовали силикатированную целлюлозу, предназначенную для прямого прессования, аэросил 200, натрия крахмала гликолят и магния стеарат. Качественное и количественное содержание дигидрокверцетина в таблетках определяли с использованием ВЭЖХ-УФ (Agilent 1260 Infinity II). Таблетки растворяли в определенном объеме подвижной фазы, а затем фильтровали раствор (0,22 мкм шприцевые фильтры PTFE, VWR, США). Использовали следующие реактивы: ацетонитрил для хроматографии и кислоту фосфорную концентрированную, ч.д.а., ГФ РФ XIV, ОФС.1.3.0001.15 «Реактивы. Индикаторы». Подвижную фазу А получали растворением 40 мл ацетонитрила в воде очищенной. В качестве подвижной фазы Б использовали 1%-й раствор фосфорной кислоты. Хроматографирование пробы объемом 10 мкл в течение 30 мин осуществляли на колонке Luna C18 150 × 4,6 мм, размер частиц 5 мкм при температуре колонки 35 °С, скорости потока – 1 мл/мин. Использовали УФ-детектор, 290 нм. Градиентные условия: время, мин – 0; подвижная фаза А-80; подвижная фаза Б-20. Определение острой, подострой токсичности и местно-раздражающего действия проводили по общепринятой методике согласно ГФ РФ ХIV на половозрелых самцах и самках белых мышей и крыс в лаборатории патоморфологии и лекарственной токсикологии ЦКП (НОЦ) РУДН. Исследование проводили на 36 здоровых половозрелых аутбредных мышах с массой тела 18–20 г и на 30 здоровых половозрелых аутбредных крысах массой тела 180–200 г. Изучаемые таблетки вводили животным однократно внутрижелудочно при помощи атравматичного зонда в виде суспензии, приготовленной на 1%-й крахмальной слизи. Препаратом сравнения служила 1%-я крахмальная слизь. Длительность наблюдения за лабораторными животными составляла 14 дней при исследовании острой токсичности и 30 дней при оценке подострой. Ежедневно проводили клинический осмотр животных, оценивали физиологические показатели, фиксировали состояние. Выбор доз осуществлялся согласно уже имеющимся данным о токсичности требованиям, описанным в нормативной документации OESD № 425. Подробный клинический осмотр животного осуществляется в клетке содержания, в руках и на открытой площадке. Отмечали проявление и выраженность, где приемлемо, признаков интоксикации. Частота осмотра зависела от выраженности картины интоксикации, но не реже чем на 2-й, 7-й и 14-й день эксперимента. Масса тела регистрировалась непосредственно перед введением на 2-е, 7-е сутки и непосредственно перед эвтаназией. Ежедневно визуально регистрировались отклонения в потреблении животными корма и воды в групповых посадочных клетках. Лишение корма производилось в ночь перед эвтаназией. Животные лишались корма, но не воды. Животных подвергали эвтаназии помещением в эксикационную камеру с эфиром через 14 дней после введения изучаемого препарата и препарата сравнения.
Результаты и обсуждение. Определены технологические характеристики субстанции дигидрокверцетина для реализации технологического процесса изготовления таблеток на его основе. Установлено, что субстанция дигидрокверцетин имеет очень плохую сыпучесть. Для улучшения технологических свойств субстанции использовались 4 вида вспомогательных веществ, позволяющие улучшить технологические свойства действующего вещества. Подобраны условия хроматографирования для определения дигидрокверцетина в таблетках методом ВЭЖХ-УФ. Определена летальная доза при однократном введении, оценены токсические эффекты при многократном повторном введении препарата «дигидрокверцетин» в лекарственной форме таблетки для приема внутрь. На лабораторных животных оценено местно-раздражающее действие препарата при пероральном применении. В ходе проведенных экспериментов установлено отсутствие местно-раздражающего действия при применении таблеток на основе дигидрокверцетина, при определении класса токсичности препарат отнесен к III классу «умеренно токсичных» веществ. На основании результатов субхронического эксперимента можно рассчитать индекс безопасности (ИБ) воспроизведенного препарата «Дигидрокверцетин, таблетки 20 мг» при применении в клинике в соответствии с прилагаемой инструкцией.
Заключение. В результате проведенных исследований разработаны состав и технология таблеток на основе дигидрокверцетина. Установлено, что оптимальная композиция для изготовления таблеток с дигидрокверцетином методом прямого прессования должна содержать наполнитель силикатированную целлюлозу, натрия крахмала гликолят, глидант аэросил и скользящий агент – магния стеарат. В ходе таблетирования подобраны режимы прессования. Оптимальная сила прессования – 5 кН. Глубина наполнения составила – 7 мм. Оптимальное разведение пуансонов оказалось равным 2,5 мм. Скорость ротора была постоянной и составляла 15 об/мин. Скорость работы питателя 25 об/мин. Разработана и валидирована методика ВЭЖХ-УФ для идентификации и определения количественного содержания дигидрокверцетина в таблетках. Показано, что на хроматограмме таблеток помимо основного пика определяются пики биофлавононов эриодиктиола и кверцетина. Это может способствовать расширению спектра фармакологической активности полученных таблеток. Проведена оценка общетоксического действия и безопасности таблеток дигидрокверцетина. Установлена среднесмертельная доза препарата (LD50), которая при пероральном применении мышам соответствовала 159 мг/кг. Внутрижелудочное применение на протяжении месяца изучаемых таблеток в дозе 100 и 200 мг/кг не вызывает патологических изменений во внутренних органах подопытных животных. При изучении гематологических и биохимических показателей крови, а также массы внутренних органов на различных сроках введения достоверных различий с группой контрольных животных не выявлено.
МЕТОДЫ АНАЛИЗА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Введение. Трава полыни горькой (Artemisia absinthium L.) применяется для рефлекторного усиления секреции желудочного сока, повышения аппетита, увеличения желчеотделения. Данные фармакологические эффекты обусловлены богатым химическим составом сырья, важным компонентом которого является эфирное масло. Изучение особенностей накопления данной группы соединений является актуальным.
Цель. Цель исследования – изучение особенностей накопления эфирного масла в траве полыни горькой, заготовленной в агро- и урбоценозах Воронежской области.
Материалы и методы. В Воронежском регионе было выбрано 13 точек заготовки сырья для изучения содержания в нем эфирного масла, которое проводили по методике ФС.2.5.0033.15 «Полыни горькой трава». Для подробного изучения влияния основных поллютантов (тяжелых металлов и мышьяка) на накопление эфирного масла анализировали коэффициенты корреляции.
Результаты и обсуждение. Все проанализированное растительное сырье признано доброкачественным по содержанию эфирного масла. Максимальное количество эфирного масла (2,04 %) отмечено в образце травы полыни горькой, произрастающей на территории Хопёрского заповедника. Минимальное количество эфирного масла отмечено в образце, собранном на улице города Воронежа (0,63 %). В целом для образцов контрольных территорий и агробиоценозов можно отметить более высокое содержание эфирного масла, чем в образцах урбобиоценозов. Так, содержание эфирного масла в траве полыни горькой, собранной на территориях, лишенных хозяйственной деятельности человека, составило 1,85–2,04 %, вблизи сельскохозяйственных угодий – 1,61–1,85 %. В ряде урбанизированных территорий были заготовлены образцы травы полыни горькой с гораздо более низким содержанием эфирного масла – менее 1 % – на улице городов Воронежа, Острогожска, Борисоглебска, вдоль трассы М4 в Рамонском и Павловском районах, вдоль железной дороги. Рассчитанные значения коэффициентов корреляции показали сильное отрицательное влияние свинца, кадмия, никеля, кобальта, цинка на накопление эфирного масла в траве полыни горькой.
Заключение. Наиболее низкое содержание эфирного масла выявлено в образцах, заготовленных на улицах крупных городов области, вдоль автомобильных трасс и железной дороги. Это позволяет сделать вывод об отрицательном влиянии антропогенной нагрузки на накопление данной группы соединений в траве полыни горькой.
Введение. Куркуминоиды являются природными полифенольными красителями, имеющими широкий спектр фармакологической активности. Для определения куркуминоидов используются как современные, так и классические методы анализа. Однако проблема анализа куркуминоидов в составе растительных и лекарственных объектов остается актуальной. Метод анализа куркуминоидов должен быть экономически доступным, но в то же время обеспечивать разделение компонентов для возможности их идентификации и количественной оценки. В настоящей работе в качестве такого метода использован капиллярный электрофорез (HPCE) в варианте мицеллярной электрокинетической хроматографии с диодно-матричным детектированием (MEKC/DAD).
Цель. Целью настоящего анализа является выбор оптимальных условий разделения куркуминоидов с использованием капиллярного электрофореза в варианте мицеллярной электрокинетической хроматографии.
Материалы и методы. Разделение куркуминоидов проводили на приборе для капиллярного электрофореза – Agilent 7100 CE с диодно-матричным детектором и системой контроля и сбора данных Agilent ChemStation. В качестве электролита использован боратный буфер (20 мМ, рН 9,3) с добавкой додецилсульфата натрия – SDS (30 мМ) в соотношениях 1 : 1. Ввод пробы осуществлялся гидродинамическим способом – 50 мБар/3 сек, напряжение на электроде – +25 кВ, капилляр кварцевый – Lэфф./Lобщ. = 30/40 см, ID = 50 µm, температура капилляра – +20 °С. Выход куркуминоидов контролировали при длине волны диодно-матричного детектора – λmax = 425 нм/4 нм, реферируемая длина волны 360 нм/100 нм.
Результаты и обсуждение. Куркуминоиды в боратном буферном растворе с добавкой SDS практически не разделяются, что связано с высокой активностью электроосмотического потока, для подавления которого добавлялся спирт этиловый 95%-й. В ходе исследований установлено, что добавка спирта этилового в количестве 20 % по отношению к буферному раствору позволяет разделять смесь куркуминоидов.
Заключение. Таким образом, подобраны условия для разделения суммы куркуминоидов методом HPCE в варианте мицеллярной электрокинетической хроматографии (MEKC). Установлено, что для разделения куркуминоидов данным методом необходимо использование электролита, состоящего из смеси равных объемов боратного буфера (20 mM) и додецилсульфата натрия (30 mM) и спирта этилового в количестве 20 % от объема электролита. Дальнейшее увеличение концентрации спирта этилового в электролите нецелесообразно, поскольку может отрицательно влиять на стабильность мицелл.
Введение. Гигиенический мониторинг загрязненности воздуха на фармацевтическом предприятии является обязательным требованием законодательства Российской Федерации (приказов, стандартов, методических указаний и руководств). Данное требование следует из необходимости защиты персонала фармацевтического предприятия от воздействия неблагоприятных условий воздушной среды рабочей зоны, в которой могут находиться взвешенные твердые частицы активных фармацевтических субстанций (АФС). Несмотря на использование персоналом средств индивидуальной защиты органов дыхания и соблюдение требований охраны труда, риск для работников должен быть сведен к минимуму за счет регулярной оценки степени загрязнения воздуха.
Цель. Целью работы является проведение гигиенического мониторинга воздуха рабочей зоны тикагрелора – АФС лекарственного препарата Брилинта®.
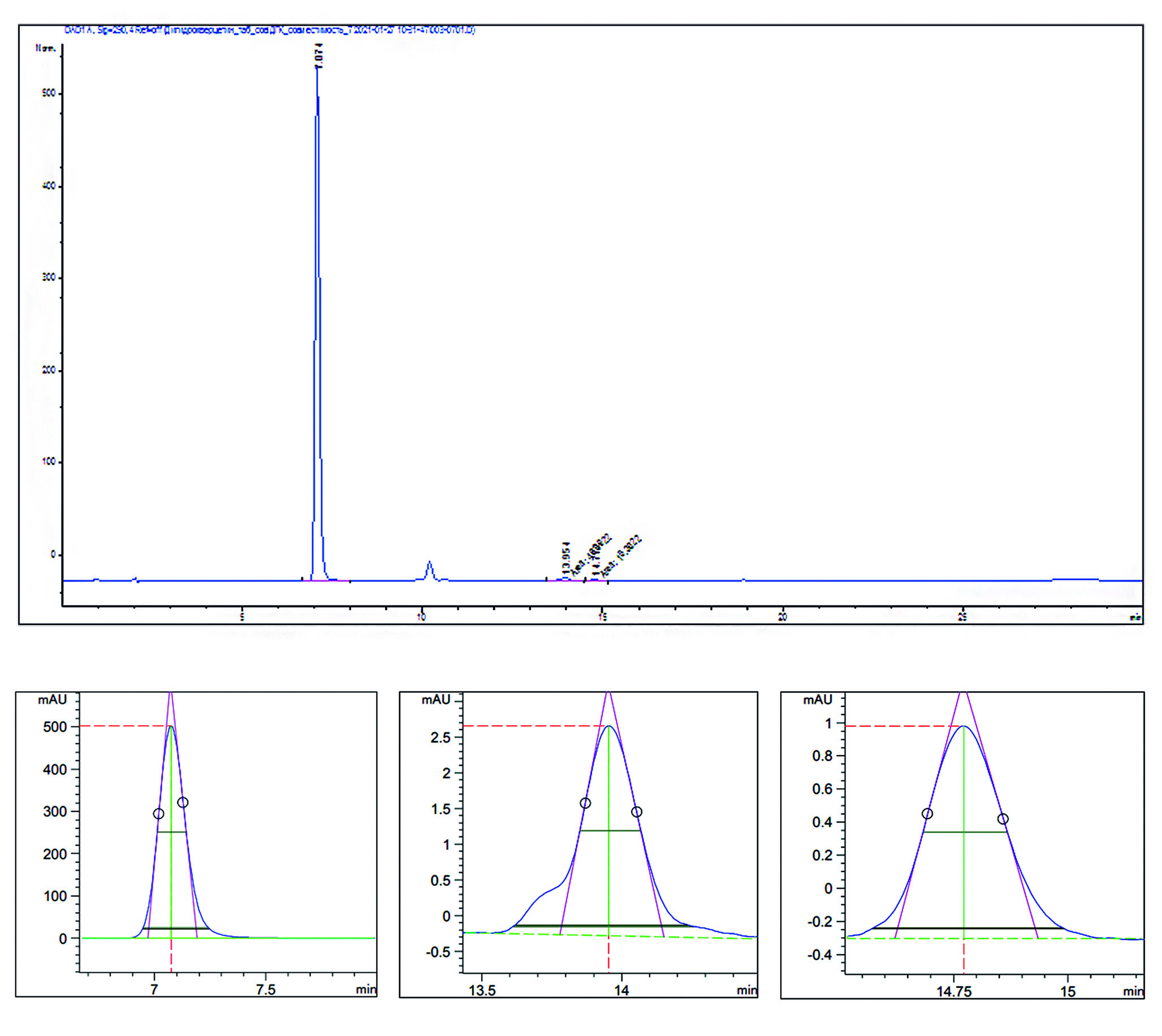
Материалы и методы. Объектом данного исследования является АФС тикагрелор, а именно: образцы воздуха и смывы с поверхности предприятия ООО «АстраЗенека Индастриз», отобранные во время производства партий препарата Брилинта® (МНН – тикагрелор). Пробоотбор воздуха рабочей зоны проводился с использованием систем забора воздуха типа «IOM Sampler» с использованием как персональных, так и стационарных систем. Смывы с поверхности проводились трафаретным методом с использованием хлопковых свабов. Выбор точек для отбора проб осуществлялся таким образом, чтобы охватить все стадии технологического цикла производства. Впоследствии количественное определение тикагрелора в образцах проводился методом высокоэффективной жидкостной хроматографии с УФ детектированием (ВЭЖХ-УФ).
Результаты и обсуждения. При анализе количественного содержания тикагрелора в образцах были обнаружены 4 пробы воздуха и 25 смывов с поверхности с превышением допустимого содержания тикагрелора. Каждая проба была соотнесена с временем и местом ее отбора, были проанализированы возможные причины превышения нормативных значений в точках отбора проб.
Заключение. На фармацевтическом предприятии был проведен гигиенический мониторинг воздуха рабочей зоны на содержание АФС тикагрелора. Были получены и обработаны результаты измерений, на основании которых были предложены меры снижения концентрации тикагрелора в воздухе, необходимые для защиты персонала от неблагоприятного воздействия рабочей зоны. Данные меры включают в себя оптимизацию технологических операции и/или обучение персонала новым подходам к эксплуатации и очистке оборудования.
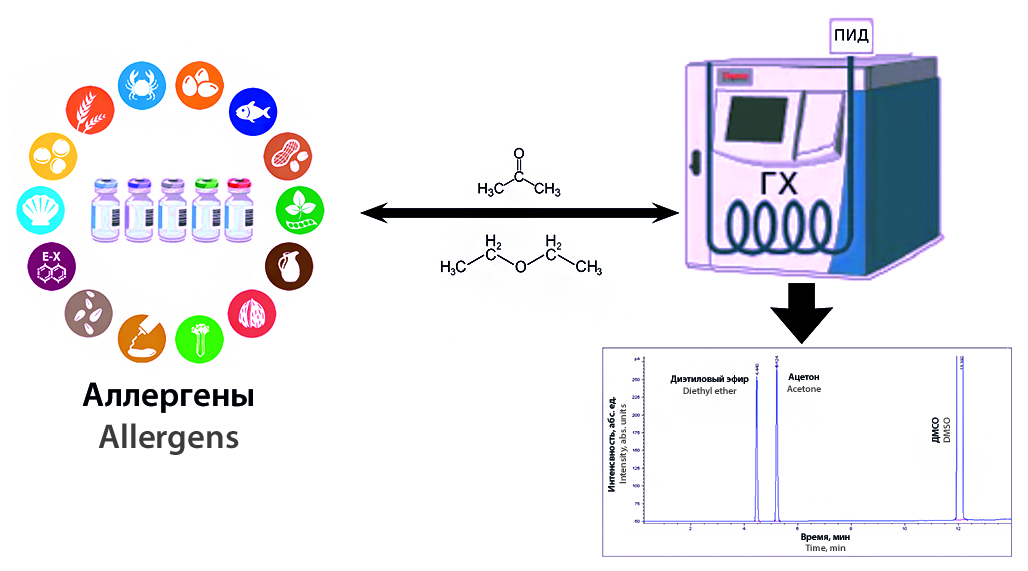
Введение. В последние десятилетия мировая фармакопейная практика уделяет особое внимание чистоте лекарственных средств. Определен перечень возможных примесей, присутствие которых в фармацевтических субстанциях и лекарственных препаратах допустим в установленных пределах, гарантирующих отсутствие токсического действия на организм человека при их приеме. Существуют примеси родственные, технологические и др. К числу технологических примесей относят, в том числе остаточные количества органических растворителей, используемых в технологии получения как фармацевтических субстанций, так и лекарственных препаратов. В рамках гармонизации требований национальной фармакопеи, фармакопеи ЕАЭС и ведущих зарубежных фармакопей в отечественную фармакопейную практику введен такой обязательный показатель качества, как содержание остаточных органических растворителей, в случае использования последних в технологическом процессе. В действующей ОФС.1.1.0008.15 «Остаточные органические растворители» указаны общие принципы определения этого показателя качества и нормативные требования к содержанию этих растворителей в зависимости от класса токсичности. При производстве препаратов аллергенов в ряде случаев, в частности при работе с пыльцевыми аллергенами, в технологическом процессе используются органические растворители третьего класса токсичности: диэтиловый эфир и ацетон, предельное содержание которых составляет до 0,5 % (5000 ppm). При этом в производственном процессе препаратов аллергенов для обезжиривания и очистки могут использоваться как диэтиловый эфир или ацетон, так и оба растворителя одновременно, поэтому для их определения целесообразна разработка и использование унифицированной методики, ориентированной на применение при оценке качества конкретного лекарственного препарата аллергена.
Цель. Целью исследования являлась разработка и валидация методики количественного определения остаточных органических растворителей в препаратах аллергенов.
Материалы и методы. Исследования проведены методом газо-жидкостной хроматографии с пламенно-ионизационным детектором с инжектированием исследуемых образцов с помощью автосэмплера на капиллярной кварцевой колонке Zebron ZB-624 (G43, 6 % цианопропилфенил / 94 % диметилполисилоксан).
Результаты и обсуждение. Подобраны условия хроматографического разделения ацетона и диэтилового эфира на капиллярной кварцевой колонке. Определены параметры пригодности хроматографической системы. Проведена валидация разработанной методики по следующим характеристикам: специфичность, линейность, предел количественного определения, правильность и прецизионность на уровне повторяемости и внутрилабораторной прецизионности. Определено содержание ацетона и диэтилового эфира в 26 препаратах аллергенов. Результаты количественного определения диэтилового эфира и ацетона в препаратах аллергенов, в технологическом процессе которых используются ООР, находятся в дипазоне 0,0053–0,0524 % для диэтилового эфира и 0,0029–0,0994 % для ацетона. Таким образом, содержание диэтилового эфира и ацетона во всех исследованных препаратах аллергенов было ниже установленной нормы (менее 0,5 %).
Заключение. Разработана аналитическая методика определения количественного содержания диэтилового эфира и ацетона в препаратах аллергенов с помощью метода ГЖХ, методика валидирована по характеристикам, отвечающим требованиям ОФС.1.1.0012.15 «Валидация аналитических методик». Проведенный в соответствии с разработанной методикой анализ препаратов аллергенов свидетельствует о том, что во всех препаратах содержание диэтилового эфира и ацетона составляет не более 0,5 %, что отвечает требованиям ОФС.1.1.0008.15 «Остаточные органические растворители». Следовательно, использование данной методики позволяет существенно повысить качество лекарственных препаратов аллергенов, в технологии получения которых используются органические растворители, так как контроль содержания их остаточных количеств гарантирует безопасность применения этих препаратов и их соответствие требованиям международных стандартов.
ДОКЛИНИЧЕСКИЕ И КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
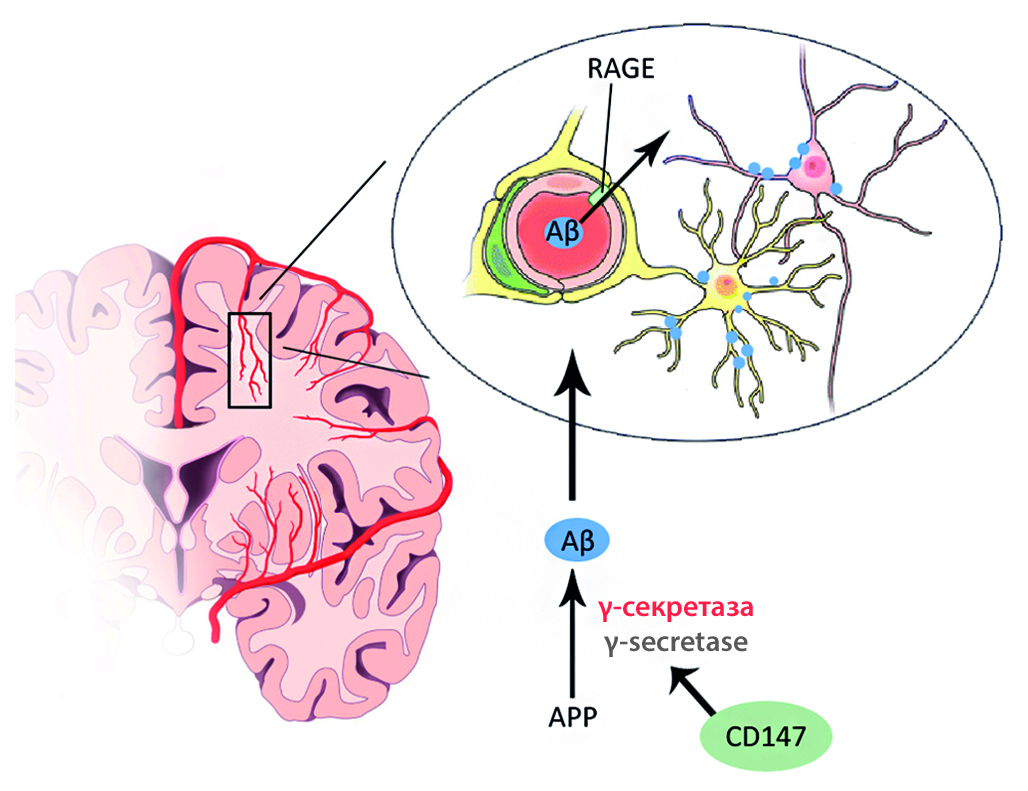
Введение. В рамках изучения болезни Альцгеймера (БА) все большую актуальность приобретает проблема причинно-следственной связи между нейродегенеративными изменениями и сопровождающей их амилоидной ангиопатией. Накопленный багаж клинических данных указывает на то, что в патогенез БА важный вклад вносят нарушения со стороны нейроваскулярной единицы, в том числе нарушения проницаемости гематоэнцефалического барьера (ГЭБ), микроциркуляции, метаболического сопряжения клеток.
Цель. Изучение молекулярных механизмов нарушения церебральной микроциркуляции и структурно-функциональной целостности ГЭБ в экспериментальных моделях БА in vitro при модуляции активности CD147 и RAGE.
Материалы и методы. Исследование провели на мышах линии C57BL/6 с формированием у животных модели БА in vivo. Далее произвели изоляцию и культивирование первичных клеток головного мозга, модуляцию активности CD147 и RAGE в клетках эндотелия in vitro с помощью siRNA CD147, siRNA RAGE, циклофилина А и Aβ1-42 и cформировали модель ГЭБ in vitro. В модели ГЭБ in vitro оценили трансэндотелиальное электрическое сопротивление. В культурах эндотелиальных клеток оценили относительное количество молекул-маркеров ангиогенеза и экспрессию гена APP. Статистическую обработку полученных результатов провели методами непараметрической статистики с помощью критерия Манна – Уитни для сравнения показателей в независимых выборках и с помощью критерия Уилкоксона для сравнения зависимых выборок. Уровень статистической значимости различий p ≤ 0,05.
Результаты и обсуждение. Блокирование экспрессии RAGE привело к статистически значимому увеличению показателей ТЭС, интенсификации ангиогенеза и снижению уровня экспрессии APP. Одновременно с этим, блокирование CD147 хотя и привело к увеличению показателей ТЭС, но также характеризовалось противоречивым действием на неоангиогенез и увеличением экспрессии APP.
Заключение. Анализируя полученные данные, можно сделать вывод, что подавление экспрессии RAGE и CD147 в клетках церебральных микрососудов может стать перспективным методом снижения их патологической проницаемости.
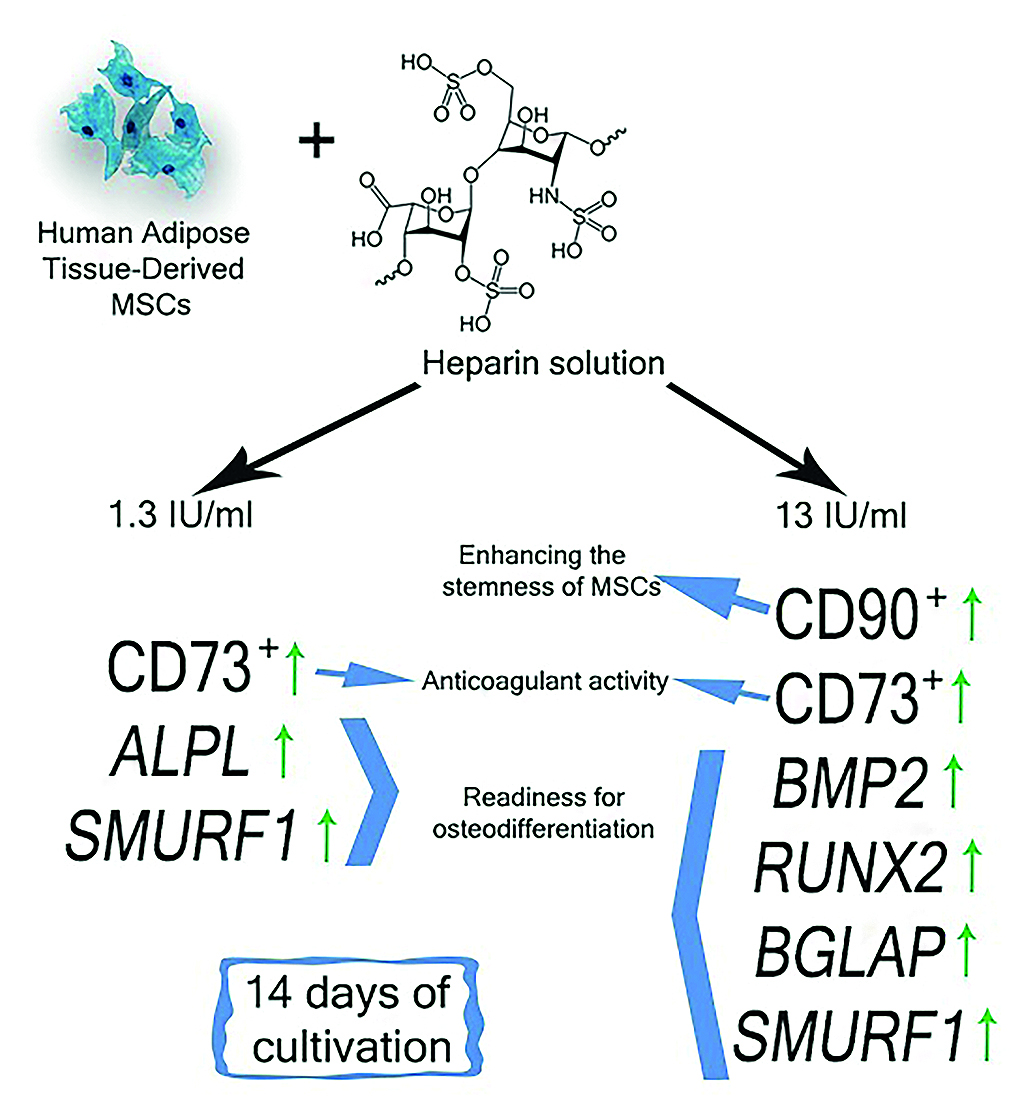
Введение. Искусственные материалы, применяемые в регенеративной медицине, при имплантации индуцируют развитие сбалансированной воспалительной реакции, что является ключевым этапом для эффективной регенерации поврежденной костной ткани. Контакт имплантата с тканями и биологическими жидкостями сопровождается осаждением белков крови на его поверхности, что способствует активации системы комплемента и инициирует коагуляционный гемостаз, приводящий к образованию фибринового сгустка. На поверхности имплантата фибрин обеспечивает адгезию стволовых клеток, их созревание в фибробласты, продуцирующие коллаген и его производные. Образующийся внеклеточный матрикс лежит в основе формирования тканевой структуры (костной мозоли). Для предотвращения развития постоперационных патологических состояний, вызванных гиперкоагуляционным синдромом, используют терапевтические стратегии с применением антикоагулянтов, таких как гепарин. Однако их использование ограничивает образование сгустка фибрина in vivo, что может замедлять миграцию мультипотентных мезенхимальных стромальных клеток (ММСК) и последующее формирование костной мозоли.
Цель. Изучение влияния гепарина в фармакологических концентрациях на «стволовость» и способность ММСК жировой ткани человека к остеогенной дифференцировке в условиях культивирования in vitro.
Материалы и методы. Для оценки морфофункционального состояния клеток, культивируемых в присутствии гепарина, было сформировано 2 экспериментальные группы: 1) ММСК в присутствии гепарина в терапевтической концентрации (1,3 МЕ/мл); 2) ММСК в присутствии гепарина в токсической концентрации (13 МЕ/мл).
Результаты и обсуждение. По результатам проточной цитометрии было выявлено, что добавление гепарина в обеих используемых в исследовании концентрациях в культуру ММСК приводит к увеличению числа клеток, экспрессирующих поверхностные маркеры CD73 и CD90, что свидетельствует о сохранении их стволового состояния. С другой стороны, выявлено стимулирующее действие гепарина также в обеих используемых концентрациях на транскрипцию в ММСК мРНК генов остеодифференцировки (BMP2, BMP6, ALPL, RUNX2, BGLAP и SMURF1), что может указывать на остеогенный потенциал гепарина для исследуемой культуры клеток.
Заключение. Результаты исследования полезны для регенеративной медицины, связанной с использованием ММСК в клинической практике; могут служить предпосылкой для разработки новых терапевтических стратегий для пациентов ортопедотравматологического профиля с высоким риском развития послеоперационных тромбозов после проведения эндопротезирования и остеосинтеза.
Введение. Коронавирусная инфекция – острое вирусное заболевание с преимущественным поражением верхних дыхательных путей, вызванное РНК-содержащим вирусом семейства Coronaviridae. Вместе с тем известно, что нейтрализующие антитела играют важную роль в противовирусной терапии, поскольку они эффективно ингибируют размножение вирусов и снижают тяжесть заболевания. Поликлональные антитела, содержащиеся в реконвалесцентной плазме, обычно используют в качестве неотложной терапии возникающих инфекционных заболеваний. В этом аспекте применение препарата иммуноглобулина G человека, содержащего специфические антитела к SARS-CoV-2 («КОВИД-глобулин»), представляется более безопасным и эффективным.
Цель. Целью исследования является изучение фармакокинетики препарата «КОВИД-глобулин» (специфический иммуноглобулин человека против COVID-19, раствор для инфузий, не менее 160 антиковидных единиц/мл (АКЕ/мл), АО «НПО Микроген», владелец регистрационного удостоверения АО «Нацимбио») в дополнение к стандартной терапии для лечения пациентов со среднетяжелым течением COVID-19.
Материалы и методы. Клинический и аналитический этапы исследования фармакокинетики препарата «КОВИД-глобулин», а также анализ безопасности и параметров фармакокинетики проводились в рамках клинического исследования изучения безопасности, переносимости и фармакокинетики препарата иммуноглобулина («КОВИД-глобулин»), раствор для инфузий, не менее 160 АКЕ/мл (АО «НПО Микроген», владелец регистрационного удостоверения АО «Нацимбио»). Количественное определение концентраций антител против SARS-CoV-2 проводилось методом иммуноферментного анализа с использованием спектрофотометрического детектирования в видимом диапазоне спектра на автоматическом планшетном иммуноферментном анализаторе Lazurite (Dynex Technologies Inc., США). Расчет фармакокинетических параметров проводился с помощью пакета Microsoft Excel с расширением для проведения фармакокинетического анализа Boomer (Department of Pharmacokinetics and Drug Metabolism, Allergan, Irvine, CA 92606, США).
Результаты и обсуждение. В исследовании не зарегистрировано ни одного серьезного нежелательного явления, а единственное нежелательное явление, которое привело к выбыванию добровольца из исследования, не связано с применением препарата. Рассчитаны фармакокинетические параметры исследуемого препарата «КОВИД-глобулин» для двух серий препаратов. Фармакокинетика препарата «КОВИД-глобулин» (содержание антител к SARS-CoV-2 – 330 АКЕ/мл) оценена на выборке из 8 добровольцев. Максимальное значение концентраций специфических антител IgG к вирусу SARS-CoV-2 составило 25,46 ± 8,71 АКЕ/мл. Значение медианы времени достижения максимальной концентрации специфических антител IgG к вирусу SARS-CoV-2 составило 0,25 часа. Специфические антитела IgG к вирусу SARS-CoV-2 элиминировались из плазмы крови со значением периода полувыведения 266,89 ± 59,92 часов. Фармакокинетика препарата «КОВИД-глобулин» (содержание антител к SARS-CoV-2 – 250 АКЕ/мл) оценена на выборке из 15 добровольцев. Максимальное значение концентрации специфических антител IgG к вирусу SARS-CoV-2 составило 20,93 ± 3,82 АКЕ/мл (Mean ± SD, где Mean – среднее арифметическое, SD – стандартное отклонение). Значение медианы времени достижения максимального значения концентрации специфических антител IgG к вирусу SARS-CoV-2 составило 0,25 часа. Специфические антитела IgG к вирусу SARS-CoV-2 элиминировались из плазмы крови со значением периода полувыведения 295,56 ± 50,68 часов.
Заключение. По результатам исследования профиль безопасности исследуемого препарата оценивается как благоприятный. По полученным в ходе аналитического этапа исследования значениям концентраций специфических антител IgG к вирусу SARS-CoV-2 рассчитаны основные фармакокинетические параметры, а также построены усредненные фармакокинетические профили исследуемого вещества после однократного введения препарата «КОВИД-глобулин». Полученные результаты явились основанием для проведения последующих фаз клинических испытаний препарата «КОВИД-глобулин».
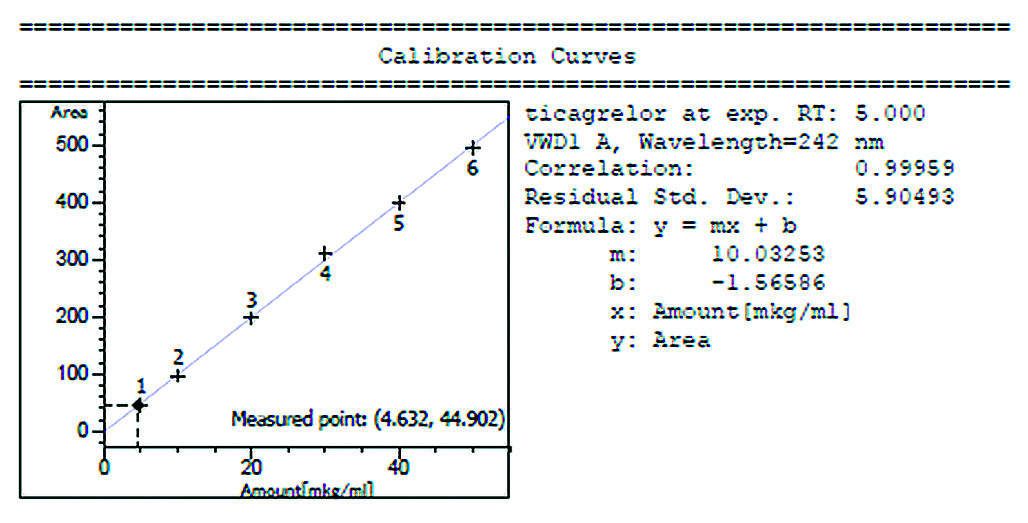
Введение. Деферазирокс является одним из наиболее известных комплексообразующих лекарственных средств и успешно применяется в хелатирующей терапии для лечения избытка железа в организме человека. Также деферазирокс входит в перечень жизненно необходимых и важнейших лекарственных препаратов, что свидетельствует о значимости данного лекарственного средства для российского здравоохранения. В указанном перечне присутствуют препараты только зарубежного производителя, поэтому в рамках тенденции к импортозамещению разработка препаратов деферазирокса отечественного производства является необходимым и перспективным направлением. В связи с чем возникает необходимость разработки методики, позволяющей с минимальными временными и ресурсными затратами количественно определить деферазирокс в плазме крови человека в рамках фармакокинетического исследования.
Цель. Целью исследования является разработка и валидация методики определения деферазирокса в плазме крови человека методом высокоэффективной жидкостной хроматографии с ультрафиолетовым детектированием (ВЭЖХ-УФ) для дальнейшего исследования фармакокинетики и биоэквивалентности лекарственных препаратов.
Материалы и методы. Определение деферазирокса в плазме крови человека проводили методом ВЭЖХ-УФ. В качестве пробоподготовки был использован способ осаждения белков ацетонитрилом. Раствор эрлотиниба использовался в качестве внутреннего стандарта. Подвижная фаза: 0,3%-й раствор ортофосфорной кислоты в воде, доведенный до pH 3,0 (элюент А) и 0,1%-й раствор муравьиной кислоты в ацетонитриле (элюент В). Колонка: Symmetry®, 75 × 4,6 мм (Waters, США). Аналитический диапазон методики для деферазирокса: 0,25–70,00 мкг/мл в плазме крови. Детектирование проводилось с помощью УФ-детектора при длине волны поглощения 299 ± 2 нм.
Результаты и обсуждение. Валидация разработанной методики проводилась по следующим валидационным параметрам: селективность, калибровочная кривая, точность, прецизионность, степень извлечения, нижний предел количественного определения, перенос пробы, стабильность (стабильность исходных и рабочих стандартных растворов аналита и внутреннего стандарта; краткосрочная стабильность; стабильность при трехкратной заморозке-разморозке аналита; долгосрочная стабильность аналита в матрице).
Заключение. Была разработана и валидирована методика определения лекарственного средства деферазирокс в плазме крови человека методом ВЭЖХ-УФ. Аналитический диапазон методики был подтвержден и составил 0,25–70,00 мкг/мл для деферазирокса в плазме крови. Данная методика была использована в рамках проведения исследования фармакокинетики и биоэквивалентности препаратов деферазирокса.
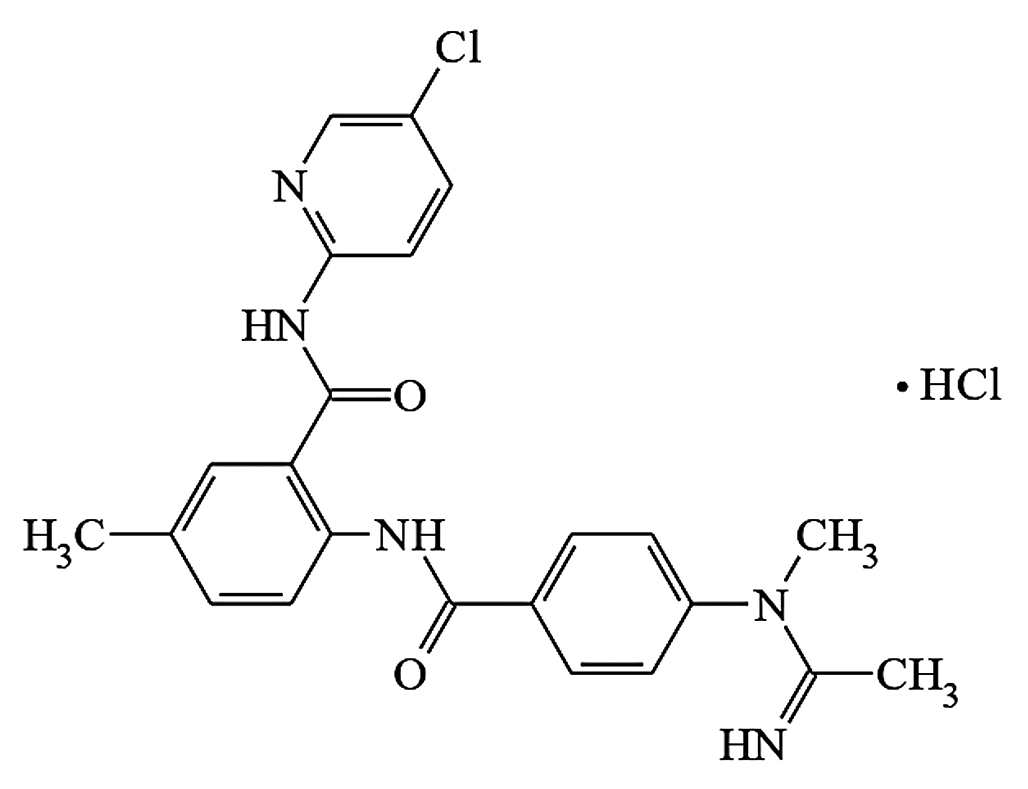
Введение. В настоящее время актуальной задачей для фармацевтической науки является поиск и разработка инновационных препаратов. Одним из таких является N-(5-хлорпиридин-2-ил)-2-({4 [этанимидоил(метил)амино]бензоил}амино)-5-метилбензамида гидрохлорид (далее – DD217) – инновационный препарат, относящийся к классу антикоагулянтов, ингибиторов фактора Xa.
Цель. Целью настоящего исследования явилась разработка и валидация методики определения DD217 в плазме крови крыс методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (ВЭЖХ-МС/МС) и применение разработанной методики для проведения фармакокинетических исследований.
Материалы и методы. В исследовании были использованы аутбредные крысы Wistar. Крысам вводили раствор субстанции DD217 однократно, внутрижелудочно в дозах 5, 15, 30 мг/кг. Для определения DD217 в плазме крови крыс применяли валидированную методику определения DD217 методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (ВЭЖХ-МС/МС). В качестве внутреннего стандарта был выбран небиволол. Хроматографическое разделение проводилось с использованием колонки Phenomenex Luna С8 (3 мкм, 50 × 4,6 мм). В качестве подвижной фазы использовали 0,1%-й раствор муравьиной кислоты в деионизованной воде и 0,1%-й раствор муравьиной кислоты в ацетонитриле. Общее время анализа каждого образца составляло 2,0 мин. DD217 и небиволол детектировали в режиме положительной ионизации электроспреем по ионным переходам m/z 436,1 → 119,9 и 406,0 → 151,0 соответственно. Фармакокинетические параметры и описательную статистику рассчитывали модельно-независимым методом при помощи программного обеспечения IBM SPSS Statistics v27 и Julia v1.6.0 (Mixed Models v3.8.0, ClinicalTrialUtilities v0.5.1).
Результаты и обсуждение. Разработанная методика была валидирована по следующим показателям: нижний предел количественного определения, селективность, правильность и прецизионность, допустимость разведения, линейность, эффект матрицы, степень извлечения, эффект переноса и стабильность. Нижний предел количественного определения DD217 в плазме крови крыс составил 2,0 нг/мл. Разработанная методика была успешно применена для определения фармакокинетических параметров субстанции DD217 в плазме крови крыс после внутрижелудочного введения в дозах 5, 15, 30 мг/кг.
Заключение. Методика для количественного определения DD217 в плазме крови впервые разработана, валидирована и применена для оценки фармакокинетических параметров субстанции DD217 в плазме крови крыс.
ЮБИЛЕИ
ISSN 2658-5049 (Online)