ОТ РЕДАКЦИИ
В этом году мероприятие было посвящено 10-летнему юбилею одноименного журнала «Разработка и регистрация лекарственных средств». Мы переработали и дополнили программу Конгресса в сравнении с мероприятиями прошлых лет, а также добавили новый для нас онлайн-формат участия. В рамках Конгресса мы обсудили вопросы, связанные с разработкой, исследованиями, производством, а также возникающие на этапе регистрации лекарственного препарата.
В этом разделе представлены приложения к предыдущим 4 частям статьи. Эти приложения важны, так как они документально подтверждают каждый шаг руководства молодой Советский республики, а затем и СССР, по восстановлению отечественной химической промышленности, разрушенной в годы Первой мировой войны и революции. Из содержания приложений, а также из фамилий ответственных сотрудников, подписавших постановления и декреты, становится понятна системность и последовательность всех действий членов правительства, а также актуальность проводимых в стране мероприятий.
ООО «Лабконцепт» – официальный дистрибьютор ведущих производителей аналитического и общелабораторного оборудования. Помимо этого, компания занимается развитием собственного ОЕМ-бренда аналитического оборудования – SILab. Под данной торговой маркой уже предлагается ряд приборов: атомно-абсорбционные спектрофотометры, ИК-фурье-спектрометры, УФ-Вид-спектрофотометры, ТОС-анализаторы и ионные хроматографы. LicArt 62 – новый продукт ООО «Лабконцепт». Это модульный жидкостный хроматограф, с широким выбором детекторов и несколькими вариантами исполнения насосов. Узловая сборка и настройка блоков хроматографа осуществляется на производственной площадке в Санкт-Петербурге, после чего все изделия проходят тщательную проверку в отделе технического контроля. При этом по техническим характеристикам системы LicArt 62 сопоставимы или превосходят жидкостные хроматографы ведущих мировых производителей, покинувших Российский рынок.
ПОИСК И РАЗРАБОТКА НОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Введение. В последнее время активно изучается противораковая активность представителей рода Artemisia L., и большая часть исследований посвящена Artemisia annua L., которая издревле применялась в традиционной медицине ряда стран как противомалярийное и противораковое средство. Сходство химического состава предопределяет изучение противораковой активности других видов рода Artemisia L. Информация об этом еще недостаточно полно представлена в научных публикациях, весьма разнородна и иногда даже противоречива. Актуальным является обзор современных исследований о противораковой активности видов рода Artemisia L., обобщение имеющихся данных и предоставление информации для будущих исследований.
Текст. В статье представлен обзор экспериментальных данных по исследованию противораковой активности представителей рода Artemisia L. Отмечается, что основной механизм такой активности – апоптоз. Апоптоз запускается за счет повышения активных форм кислорода (АФК) внутри раковых клеток, снижения мембранного потенциала митохондрий, активации проапоптотических и, наоборот, ингибирования антиапоптотических белков, а также за счет образования мембранных пузырьков, сжатия клеток и посредством активации каспаз.
Заключение. В представленном обзоре охвачено около 30 видов рода Artemisia L. При представленной степени изученности данного направления остается нерешенным ряд вопросов. Наиболее изучены в отношении цитотоксической активности Artemisia absinthium L. и Artemisia vulgaris L. В этом аспекте перспективно исследование других близкородственных видов рода Artemisia L. Также актуальным является изучение цитотоксичности представителей рода полынь на нормальные культуры клеток и в сравнении с положительным контролем. Кроме того, значимым остается детальное изучение пула вторичных метаболитов различных видов рода Artemisia L. с целью достоверного определения компонентов, отвечающих за проявление противоракового действия. Выраженная эффективность представителей рода Artemisia L. в отношении раковых клеток и одновременно слабое воздействие на здоровые клетки открывает перспективу их применения в качестве источников препаратов-партнеров, обладающих синергетическим эффектом, и как средств аугментации противоопухолевой терапии.
Introduction. Chemotherapy with Cabazitaxel (CBZ) is a typical first-line treatment option for naïive castration-resistant prostate cancer resistant to docetaxel. On the other hand, Cabazitaxel's therapeutic success is constrained by chemoresistance and side effects.
Aim. To assess whether 6 alpha-ethylchenodeoxycholic acid (6-ECDCA), a selective agonist for bile acid receptors will enhance the efficacy of CBZ in androgen-independent prostate cancer cells.
Materials and methods. The 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) viability assay was used to assess the cytotoxicity of 6-ECDCA and CBZ medicines or their combinations against the human prostate cancer cell line (PC-3). The combination outcome suggested by Chou TC et al. was then evaluated using the combination index (CI) to find out the nature of synergism, antagonism, and additive effect of the drug’s combination. Furthermore, the Dose-Reduction Index (DRI) was determined to measure how many times the dose could be reduced for each drug in a synergistic combination.
Results and discussion. Analysis of the dose-effect curve showed that the treatment of PC-3 cells with CBZ alone or combined with 6-ECDCA for 48 h led to 50 % cytotoxicity of 20.5 nM and 4.7 nM, respectively. 6-ECDCA at 1.77 µM had an additive effect based on the CI value, which was 1.02, while at 21.02 µM, the CI was 0.54 which designates a strong synergistic effect. The combination of CBZ and 6-ECDCA at a submaximal lower dose by 6-folds of each one produced a 95 % cell death than treatment with either agent alone.
Conclusion. The Combination index plot showed CI ≤ l for all combinations used in this study, which indicates additive and synergistic interactions between CBZ and 6-ECDCA. The significant impact of 6-ECDCA in combination with CBZ for treating androgen-independent prostate cancer cells was confirmed by this study to be preferred to the treatment with a single drug.
ФАРМАЦЕВТИЧЕСКАЯ ТЕХНОЛОГИЯ
Введение. Полисахариды морского происхождения являются многообещающими кандидатами для создания инновационных лекарственных средств. Одним из таких соединений является полисахарид фукоидан из бурых водорослей, обладающий антикоагулянтной и противовоспалительной активностью. Создание топических трансдермальных препаратов для лечения хронических заболеваний вен представляет особый интерес, т. к. при адресной доставке действующее вещество в высокой концентрации попадает непосредственно на участок, где требуется воздействие лекарственного средства, при этом риск развития нежелательных побочных эффектов минимален.
Цель. Экспериментально-теоретическое обоснование методологической схемы разработки трансдермальной системы доставки морского полисахарида фукоидана в рамках подхода Quality by Design (QbD) для местной терапии.
Материалы и методы. Использовали субстанцию Фукоидан, выделенную по оригинальной технологии ММБИ РАН из слоевищ фукуса пузырчатого Fucus vesiculosus L. Баренцева моря. В работе использовали вспомогательные вещества, разрешенные к медицинскому применению. Выбор состава вспомогательных веществ трансдермальной системы доставки (ТСД) проводили по плану греко-латинского квадрата 4 × 4 с повторными наблюдениями. В качестве физико-химических показателей оценивали рН водных извлечений ТСД, коллоидную и термическую стабильность. Структурно-механические свойства оптимального состава ТСД определяли на ротационном вискозиметре. Скорость растворения in vitro оценивали с использованием метода «мешалка над диском» при температуре 32 ± 0.5 °С.
Результаты и обсуждение. Проведена разработка состава и технологии топической ТСД фукоидана с применением концепции QbD. В результате разработки в качестве топической формы с фукоиданом выбраны состав и технология ТСД фукоидана с содержанием действующего вещества 15 %, обладающий термо- и коллоидной стабильностью, имеющий водородный показатель, приближенный к рН кожи человека. В качестве гелевой основы использован полоксамер 407, в качестве гидрофобной фазы – масло оливковое. Установлено, что отношение полоксамера 407 к водной фазе должно быть не менее 0.1 и не более 0.37; отношение воды к водной фазе должно быть не менее 0.56 и не более 0.69; и полиоксил 40 гидрогенизированное касторовое масло к масляной фазе должно быть не менее 0.34. Определено, что 9 % полоксамера 407 обеспечивает необходимые структурно-механические свойства ТСД. Установлено, что разработанная ТСД фукоидана с полоксамером 407 относится к неньютоновским типам течения с пластическими свойствами и имеет тиксотропность.
Заключение. Проведенный комплекс исследований позволил экспериментально-теоретически обосновать методологическую схему разработки трансдермальной системы доставки морского полисахарида фукоидана в рамках подхода QbD. Методологическая схема учитывает физико-химические и технологические особенности фукоидана и позволяет создать высококачественную ТСД, обеспечивающую стабильность и полное высвобождение действующего вещества.
Введение. ЛХС-1269 − производное индолокарбазола, обладающее высокой противоопухолевой активностью. В связи с гидрофобными свойствами активной субстанции для получения инъекционной лекарственной формы (ЛФ) требуется использование органических сорастворителей – диметилсульфоксида (ДМСО) и этилового спирта. Однако включение органических растворителей в состав ЛФ несет потенциальный риск возникновения побочных эффектов в результате применения препарата.
Цель. Подбор композиции вспомогательных веществ для получения водного раствора гидрофобного производного индолокарбазола, позволяющей максимально снизить концентрацию органических растворителей в составе ЛФ.
Материалы и методы. Объект исследования – активная субстанция ЛХС-1269 серии 010320, произведенная в лаборатории химического синтеза ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России. Для получения модельных составов применяли следующие вспомогательные вещества: Kollidon® 17 PF, Kollisolv® PEG-400, Kolliphor® P 188, Montanox™ 20, ДМСО ч.д.а., спирт этиловый 95 % ФС.2.1.0036.15, спирт бензиловый х.ч., вода для инъекций ФС.2.2.0019.18. Для отвешивания ЛХС-1269 и вспомогательных веществ использованы весы аналитические OHAUS Analytical Plus AP100S и весы лабораторные AND DL-120. Растворение и смешивание компонентов проводили на магнитной мешалке IKA® C-MAG HS 4.
Результаты и обсуждение. В ходе исследования были получены и оценены 2 группы модельных композиций, включающих в качестве солюбилизатора комплекс из двух и более вспомогательных веществ. Первая группа составов содержала ДМСО в концентрации 5 % и этиловый спирт в концентрациях от 0 до 15 %. Композиции второй группы включали ДМСО от 0 до 4 %. В результате установлено, что добавление 5 % Kolliphor® P 188 в состав раствора позволяет снизить содержание спирта этилового до 5 %. При этом при дальнейшем снижении содержания этанола наблюдается помутнение раствора и выпадение осадка. Уменьшения концентрации ДМСО в ЛФ до 2 % удалось добиться путем использования комбинации 20 % этанола и комплекса солюбилизаторов − Kollidon® 17 (20 %), Kollisolv® PEG-400 (20 %) и Kolliphor® P 188 (5 %). При этом полное растворение активной субстанции без ДМСО наблюдалось при компенсации данного органического растворителя путем введения дополнительных вспомогательных веществ − Montanox™ 20 (5 %) и бензола (2 %).
Заключение. В результате проведенных исследований подобраны композиции вспомогательных веществ из класса солюбилизаторов, позволяющих получить водный раствор гидрофобного соединения ЛХС-1269 с минимальной концентрацией органических растворителей.
МЕТОДЫ АНАЛИЗА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Введение. Препараты эноксапарина натрия включены в актуальные протоколы лечения COVID-19. При увеличении объема выпуска таких препаратов лаборатории контроля качества испытывают потребность в доступных и точных методиках идентификации и количественного определения активного вещества в лекарственных средствах. Учитывая, что фармакопейные методы требуют дорогостоящих стандартов, реагентов, недоступных многим лабораториям, разработка более доступного метода позволит ускорить и удешевить процесс контроля качества препаратов, содержащих эноксапарин натрия.
Цель. Разработка и валидация простого, экономичного, точного метода гельпроникающей высокоэффективной жидкостной хроматографии (ВЭЖХ) с применением рефрактометрического детектора для оценки эноксапарина натрия в инъекционных препаратах.
Материалы и методы. Объектом исследования явились образцы субстанции и коммерческих препаратов, содержащих эноксапарин натрия. Определение подлинности и количественного содержания активного вещества проводили методом гельпроникающей ВЭЖХ на хроматографе 1260 Infinity (Agilent Technologies, США), оснащенном дифференциальным рефрактометрическим детектором.
Результаты и обсуждение. В ходе работы проанализированы стандартные валидационные характеристики: специфичность, линейность, прецизионность и правильность метода. Анализ данных показал высокую специфичность и пригодность разработанной методики критериям приемлемости для хроматографических систем. Метод рекомендован к использованию для рутинного контроля готовых лекарственных средств или полупродукта, содержащих от 25 до 200 мг/мл эноксапарина натрия.
Заключение. Разработанный метод является пригодным для использования в рутинном контроле качества инъекционных препаратов, содержащих эноксапарин натрия в качестве действующего вещества.
Введение. Химический состав растений является совокупностью всех первичных и вторичных метаболитов и может рассматриваться как результат реализации генетической информации, «связующее звено» между генотипом и фенотипом. Комплекс биологически активных веществ (БАВ) большинства лекарственных растений и получаемых на их основе лекарственных растительных препаратов представляет собой многокомпонентную систему, находящуюся во взаимодействии, состав которой не всегда известен полностью. Облепиха крушиновидная – одно из ценных растений, имеющее широкий ареал распространения. Плоды облепихи содержат большое количество классов различных БАВ. Исследования изменчивости химического состава в зависимости от климатических условий произрастания, заготовки и сушки с целью накопления и обобщения информации для выработки унифицированных научно обоснованных норм показателей качества сырья является актуальным направлением для изучения.
Цель. Целью настоящей работы являлось изучение химического состава плодов облепихи крушиновидной, произрастающей на территории Центрального Черноземья.
Материалы и методы. Сырьем для проведения анализа служили цельные свежие плоды облепихи крушиновидной, заготовленные на территории Центрального Черноземья РФ (Воронежская область). В работе методом ТСХ проведено исследование состава различных групп БАВ и их идентификация в извлечениях из изучаемого сырья. В процессе комплексного изучения химического состава плодов проведено определение каротиноидов, флавоноидов, дубильных веществ, аминокислот, гидроксикоричных кислот, антоцианов, органических кислот, сахаров, некоторых макроэлементов и витаминов.
Результаты и обсуждение. Плоды облепихи крушиновидной, произрастающей в условиях Центрального Черноземья, накапливают в значительных количествах свободные аминокислоты, дубильные вещества, органические кислоты и полисахариды. Методом капиллярного электрофореза в плодах облепихи крушиновидной исследован состав свободных водорастворимых простых сахаров, органических кислот, витаминов группы В, а также полный аминокислотный состав. Установлено значительное содержание рибофлавина и холина, а также яблочной и янтарной кислот. Результаты ВЭЖХ-анализа показали, что флавоноиды в плодах облепихи крушиновидной, произрастающей в условиях Центрального Черноземья представлены флавонолгликозидами – производными кверцетина, кемпферола и изорамнетина. В качестве хемомаркеров могут быть использованы минорные флаволгликозиды 3-рутинозид-7-рамнозиды изорамнетина, кверцетина и кемпферола, 3-софорозид-7-рамнозиды кверцетина и кемпферола, рутин, 3-глюкозид и 3-рамнозид изорамнетина.
Заключение. Полученные данные о компонентном составе фенольной фракции плодов исследуемых образцов облепихи крушиновидной схожи с литературными данными об облепихе того же вида различных сортов, заготовленных в условиях Средней полосы РФ (Московская область).
Введение. Современные биотехнологические препараты представлены преимущественно высокогликозилированными белками. Подавляющее большинство таких препаратов, выпускаемых отечественными биофармацевтическими компаниями, являются биоаналогами зарубежных препаратов. Основа разработки таких препаратов – аналитические исследования, направленные на подтверждение эквивалентности структур биоаналога и эталона. Наибольшую аналитическую сложность представляют Fc-слитые препараты, сочетающие в себе свойства эффекторных белков и кристаллизующегося фрагмента IgG1. Единственным биоаналогом такого вида, зарегистрированным в России, является этанерцепт, который был выбран в качестве объекта исследования. Существующие классические походы не позволяют точно и достоверно определять гликановый профиль таких препаратов. Разработка подходов и принципов таких исследований необходима, так как изменение структуры биоаналога в процессе производства может оказать большое влияние на его эффективность и безопасность.
Цель. Разработка подходов двойного протеолиза, позволяющих провести гликопептидное картирование Fc-слитого белка этанерцепта с использованием протеазы Arg-C.
Материалы и методы. Этанерцепт подвергался энзиматическому гидролизу с применением комбинаций трипсина с одной из двух протеаз (Arg-C или Asp-N). Образующиеся пептиды идентифицировались методом ВЭЖХ-МС/МСВР. Подтверждение структуры гликанов осуществлялось по фрагментным спектрам гликопептидов, полученным в режиме повышенной энергии столкновений (MSE).
Результаты и обсуждение. Использование комбинации трипсина с Arg-C приводило к надежным результатам. Разработанный подход позволил определить большинство участков О-гликозилирования и установить типы О-гликанов этанерцепта. Показано, что для эффективного О-гликопептидного картирования необходима стадия N-дегликозилирования. N-гликопептидным картированием были идентифицированы основные формы N-гликанов каждого из трех участков N-гликозилирования (N149, N171, N317). Установлено, что применение комбинации трипсина с Arg-C позволяет идентифицировать трехантенные формы, несмотря на наличие в образующемся пептиде участка О-гликозилирования. Общий профиль N-гликозилирования, выраженный как процент от суммарного отклика всех идентифицированных гликоформ, показывает сопоставимость результатов при использовании разработанного подхода.
Заключение. В результате проведенного исследования нами были разработаны подходы гликопептидного картирования, включающие использование комбинаций протеаз, которые позволяют надежно и воспроизводимо определять локализацию участков и формы N- и О-гликозилирования этанерцепта. Разработанные подходы могут использоваться для проведения исследований сопоставимости биоподобных лекарственных средств, оценки качества при изменении технологии производства лекарственных препаратов (ЛП), при разработке новых биотехнологических ЛП.
Введение. Перспективными источниками биологически активных соединений (БАС) являются экстракты, полученные из различных морфологических частей растений многочисленного рода Astragalus L. Одними из основных групп БАС, выделенных из растений этого рода, являются флавоноиды, сапонины и полисахариды. Достаточно изученными являются Astragalus membranaceus (Fisch.) Bunge) и Astragalus mongholicus Bge., экстракты которых обладают широким спектром фармакологической активности. Расширение номенклатуры лекарственного растительного сырья и исследование групп БАС, определяющих основные фармакологические эффекты, являются актуальными исследованиями в фармакогнозии. С этой точки зрения представляют интерес малоизученные виды астрагала (Astragalus henningii (Stev.) Klok., Astragalus testiculatus Pall., Astragalus varius S.G. Gmel., Astragalus dasyanthus Pall.), массово произрастающие на территории Поволжья.
Цель. Выделение и идентификация 5-ти агликонов флавоноидов в гидролизатах водно-спиртовых извлечений из травы астрагала: A. henningii, A. testiculatus, A.varius, A. dasyanthus методом ВЭЖХ/УФ.
Материалы и методы. Объектами исследования являлась трава четырех видов астрагала (A. henningii, A. testiculatus, A.varius, A. dasyanthus), заготовленная в период массового цветения на территории Саратовской области и высушенная до воздушно-сухого состояния. Для изучения состава фенольных соединений проводили экстракцию 70%-м этиловым спиртом в соотношении сырье : экстрагент (1 : 10) путем настаивания в течение 7 дней. Кислотный гидролиз проводили хлористоводородной кислотой 37 % при нагревании в течение 40 минут. Полученные гидролизаты анализировали на хроматографе Agilent 1260 (Agilent Technologies, США) с диодно-матричным детектором, ручным вводом проб (ручной инжектор Agilent G1328C, Agilent Technologies США) и системой для сбора и обработки хроматографических данных Agilent OpenLab CDS по индивидуально подобранному градиенту элюирования подвижной фазы (0,1%-й раствор ортофосфорной кислоты/ацетонитрил). Соединения в гидролизатах идентифицировали по временам удерживания и УФ-спектрам смеси стандартных образцов (СО): кверцетина, изорамнетина, лютеолина, кемпферола и апигенина.
Результаты и обсуждение. Подобран градиент элюирования для одновременного определения 5 агликонов флавоноидов с единичным временем анализа 13 минут. Данные условия позволили идентифицировать соединения в гидролизатах водно-спиртовых извлечений четырёх видов астрагала. Лютеолин, кверцетин и апигенин обнаружены в гидролизатах A. henningii, A. testiculatus, A. varius, изорамнетин и кемпферол обнаружены в A. henningii и A. varius. Ни один из анализируемых агликонов не найден в гидролизате A. dasyanthus.
Заключение. После предварительного подбора оптимальных условий хроматографического разделения смеси 5 агликонов флавоноидов были проанализированы гидролизаты четырех видов астрагала. Полученные данные указывают на перспективность дальнейшего изучения химического состава астрагалов и подтверждают целесообразность их использования для получения новых фитопрепаратов.
Введение. В лаборатории разработки лекарственных форм ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России разработана липосомальная лекарственная форма ФС тетра-3-фенилтио-фталоцианина гидроксиалюминия (ТФГА), для которой необходимо было разработать простую, точную и легко воспроизводимую методику количественного определения основного действующего вещества и вспомогательных веществ в составе лекарственного средства. В качестве такой методики была выбрана высокоэффективная тонкослойная хроматография (ВЭТСХ).
Цель. Разработка хроматографических методик количественного определения вспомогательных веществ в липосомальной лекарственной форме ФС ТФГА и для определения подлинности.
Материалы и методы. Определение веществ проводили методом ВЭТСХ с последующей хроматоденситометрией. Для проведения анализа использовали субстанцию ТФГА (ФГУП «ГНЦ «НИОПИК», Россия), плацебо лиофилизированной липосомальной формы без ТФГА в составе (ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России), яичный фосфатидилхолин (96 %, CAS № 97281-44-2, ЕPC, Lipoid GmbH, Германия), холестерин (≥99 %, CAS № C8667, Sigma-Aldrich, Япония), сахарозу (ч.д.а., ООО ТД «ХИММЕД», Россия) и различные органические растворители.
Результаты и обсуждение. После проведения серий собственных экспериментов была выбрана подвижная фаза для проведения ВЭТСХ-анализа: изопропанол : 25%-й водный аммиак (80 : 20 об/об), при этом время разделения составило 20–25 мин (l = 75 мм), t = 20 °С. Для визуализации пятен сахарозы, фосфатидилхолина и холестерина выбрали 5%-й раствор фосфорномолибденовой кислоты. Устойчивость стандартных образцов была подтверждена на серии предвалидационных исследований. Проведена валидация методики.
Заключение. Для количественного определения сахарозы, фосфатидилхолина и холестерина в новой липосомальной лекарственной форме выбран метод ВЭТСХ с хроматоденситометрией, который позволяет идентифицировать сразу все три компонента в составе лекарственной формы. Проведена валидация методики.
Введение. Надежность оценки качества и безопасности лекарственных средств (ЛС) по биологическим показателям напрямую связана с применением питательных сред (ПС), отвечающих установленным требованиям. Однако при проведении испытаний следует учитывать особенности питательных сред, обусловленные наличием в их составе компонентов биологического происхождения. В частности, высокая степень вариабельности и неустойчивая стабильность сырья, а также возможные ошибки при приготовлении и хранении сред, создают предпосылки для возникновения отклонений. Использование питательных сред промышленного производства также не гарантирует их пригодность для соответствующего испытания. Для получения достоверных результатов соответствие каждой партии ПС заданным критериям должно подтверждаться стандартными методами с использованием всего перечня значимых показателей. Отсутствие в настоящее время в Российской Федерации государственного стандарта, регламентирующего требования к порядку использования питательных сред при подтверждении качества лекарственных средств, значительно затрудняет оценку пригодности, сопоставимости и достоверности результатов анализа, как самих ПС, так и фармацевтических препаратов.
Текст. В статье рассматривается проект общей фармакопейной статьи (ОФС) «Питательные среды», в котором представлены общие требования к питательным средам при использовании их в фармакопейном анализе. Стандарт предназначен для специалистов занимающихся разработкой, совершенствованием и применением методов и/или методик, необходимых для подтверждения свойств лекарственных препаратов с целью регистрации, ввода в гражданский оборот, а также при их производстве. Документ составлен с учетом современных отечественных и международных подходов надлежащих фармацевтических практик к оценке качества ЛС, предусматривающих применение питательных сред. В проекте определены ключевые факторы в наибольшей степени, влияющие на качество питательных сред. На основе принципа преемственности составлен и подробно описан комплекс стандартизованных методов контроля, включая испытания по физико-химическим и биологическим показателям. Приведены критерии пригодности. Для исследования специфических свойств установлены требования к тестовым культурам. Регламентируются особые требования к питательным средам, используемым для получения биологических лекарственных препаратов. Описана процедура хранения и утилизации питательных сред, непригодных для использования.
Заключение. Введение ОФС «Питательные среды» в практику отечественного фармакопейного анализа позволит повысить достоверность результатов оценки эффективности и безопасности лекарственных средств, и как следствие приведет к снижению производственных рисков и рисков причинения вреда здоровью пациентов при фармакотерапии и иммунопрофилактике. Предложенные подходы могут быть использованы в других отраслях науки и производства.
Введение. В рамках сравнительной оценки качества лекарственных препаратов, представленных на рынке РФ, проведено исследование теста сравнительной кинетики растворения (ТСКР) и показателя однородности дозирования долей таблеток для семи торговых наименований лекарственных препаратов с МНН «Каптоприл» различных производителей. ТСКР проводили в трех средах растворения (0,1 M раствор хлористоводородной кислоты, ацетатный буферный раствор рН 4,5 и фосфатный буферный раствор рН 6,8) на основании отбора проб по временным точкам 0, 5, 10, 15, 20, 30 мин и их анализа методом УФ-спектрофотометрии при длине волны 212 нм. Проведено сопоставление кинетики высвобождения действующего вещества на основании расчета фактора подобия f2 и значений относительных стандартных отклонений. Результаты однородности дозирования половин таблеток оценивали на основании расчета фактора АV, анализируя образцы при помощи метода ВЭЖХ-УФ.
Цель. Целью настоящего исследования являлась сравнительная оценка лекарственных препаратов с МНН «Каптоприл» различных производителей, представленных на рынке РФ, на основании исследований однородности дозирования и теста кинетики растворения как критериев оценки качества объектов.
Материалы и методы. Исследование ТСКР проводили с использованием тестера растворения DT 827/1000 (ERWEKA GmbH, Германия). Каждый лекарственный препарат анализировали в трех средах растворения по 12 повторах для каждой среды растворения. Отобранные пробы анализировали на УФ-спектрофотометре UV 1800 (Shimadzu, Япония) при длине волны 212 нм. При исследовании однородности дозирования половин таблеток проводили деление таблеток в соответствии с нанесенной риской, в случае если такая была нанесена, после чего проводили пробоподготовку в соответствии с валидированной методикой, полученные пробы анализировали методом ВЭЖХ-УФ на системе Agilent 1260 (Agilent Technologies, США).
Результаты и обсуждение. На основании результатов ТСКР и проведенных расчетов факторов подобия и значений относительного стандартного отклонения можно сделать вывод о неэквивалентности кинетики высвобождения для ЛП № 4, ЛП № 5, ЛП № 6 в сравнение с референтным препаратом. Проведённое исследование однородности дозирования действующего вещества не выявило отклонений в соответствии с требованиями ГФ РФ, ОФС.1.4.2.0008.18 «Однородность дозирования» и Фармакопеи ЕАЭС ОФС.2.1.9.14 «Однородность дозированных единиц».
Заключение. Проведенные выборочные анализы лекарственных препаратов по показателям ТСКР и однородности дозирования на своем примере показывают возможность выявить потенциальные проблемы качества лекарственный препаратов, представленных на рынке РФ, а следовательно, развивать и поддерживать обеспечение качества лекарственных препаратов для национальной системы здравоохранения.
ДОКЛИНИЧЕСКИЕ И КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Введение. В рамках регистрации комбинированного препарата «Эзетимиб + розувастатин» (АО «Санофи-авентис груп», Россия) было проведено исследование его биоэкивалентности по сравнению с совместно принимаемым монокомпонентным препаратом Эзетрол® (эзетимиб) и Крестор® (розувастатин) с участием 76 здоровых добровольцев. Для оценки фармакокинетики общего эзетимиба использовали ферментативный гидролиз, что послужило причиной для включения дополнительных контролируемых параметров в валидацию и анализ.
Цель. Целью настоящего исследования являлось изучение сравнительной фармакокинетики и подтверждение биоэквивалентности двухкомпонентного действующего препарата «Эзетимиб + розувастатин» (эзетимиб + розувастатин, таблетки, 10 + 40 мг, АО «Санофи-авентис груп», Россия) относительно совместно принимаемых монокомпонентных препаратов эзетимиба и розувастатина у здоровых добровольцев после однократного приема натощак с использованием в ходе анализа проб описанных дополнительных параметров контроля ферментативного гидролиза эзетимиб-глюкуронида.
Материалы и методы. Для подтверждения биоэквивалентности было проведено открытое, сравнительное, рандомизированное, перекрестное клиническое исследование с двумя этапами. В ходе исследования у добровольцев отбирались образцы плазмы крови, в которых при помощи валидированных ВЭЖХ-МС/МС методик определялись концентрации свободного эзетимиба (неконьюгированного), общего эзетимиба (эзетимиб + эзетимиб-глюкуронид) и розувастатина. На основании полученных данных был проведен фармакокинетический и статистический анализ, и рассчитаны доверительные интервалы (ДИ) для фармакокинетических параметров Сmax и AUC0-72.
Результаты и обсуждение. На основании полученных результатов сделано заключение, что фармакокинетические параметры сравниваемых препаратов характеризуются высоким сходством в отношении как эзетимиба (свободного), так и розувастатина. Данные о фармакокинетических параметрах общего эзетимиба являлись второстепенными и не требовались для заключения о биоэквивалентности препаратов. В ходе ВЭЖХ-МС/МС анализа клинических образцов дополнительные параметры контроля ферментативного гидролиза эзетимиб-глюкуронида позволяли обоснованно отвергать результаты недостоверных аналитических серий.
Заключение. Таким образом, согласно применяемым критериям, препараты признаны биоэквивалентными. Описанные дополнительные параметры контроля ферментативного гидролиза эзетимиб-глюкуронида продемонстрировали свою эффективность.
Введение. Применение иммуноглобулинов, содержащих нейтрализующие SARS-CoV-2 антитела, может быть эффективным и безопасным средством лечения COVID-19. В Акционерном обществе «Нацимбио» был разработан препарат «КОВИД-глобулин» – иммуноглобулин для внутривенного введения из плазмы крови доноров, содержащей вируснейтрализующие антитела против SARS-CoV-2.
Цель. Целью исследования является экспериментальное изучение безопасности препарата «КОВИД-глобулин».
Материалы и методы. При исследовании безопасности препарата в опытах на животных были оценены следующие показатели: общая токсичность, тромбогенный потенциал, влияние на гематологические и биохимические показатели, свертываемость крови и гемолитическую активность, определение местного раздражающего действия, пирогенных свойств, бактериальных эндотоксинов и аллергизирующего действия препарата, а также его физико-химические свойства.
Результаты и обсуждение. Исследования безопасности «КОВИД-глобулина» в опытах на животных показали отсутствие каких-либо признаков интоксикации и местного раздражающего действия. Макроскопическое и гистологическое исследование органов крыс, получавших КОВИД-глобулин, не выявило признаков некроза, воспаления или каких-либо существенных патологических изменений. Гематологические и биохимические показатели крови лабораторных животных после введения «КОВИД-глобулина» соответствовали норме. Введение «КОВИД-глобулина» кроликам не вызывало образование тромбов. Распределение по подклассам IgG в препарате соответствовало их содержанию в плазме крови человека. Активность Fc-функции молекулы иммуноглобулина составила более 130 % по сравнению с контрольным препаратом, концентрация активатора прекалликреина в препарате «КОВИД-глобулин» находилась в диапазоне от 4,2 до 4,8 МЕ/мл, антикомплементарная активность составила менее 1 ед. комплемента на 1 мг белка.
Заключение. Результаты всех проведенных исследований продемонстрировали высокий уровень безопасности разработанного препарата «КОВИД-глобулин», полностью соответствующего требованиям, предъявляемым к иммуноглобулинам человека для внутривенного введения отечественными нормативными документами и Европейской Фармакопеей.
Введение. Поведенческие методы на лабораторных животных признаны основным подходом при изучении активности потенциальных психотропных средств и позволяют оценить основные эффекты новых соединений, повысить возможность прогнозирования удачного исхода будущих клинических испытаний.
Текст. В предлагаемой обзорной статье осуществлен анализ основных современных поведенческих моделей на грызунах, широко применяемых для скрининга и изучения фармакологической активности потенциальных психотропных средств. Выделены преимущества и недостатки каждого теста и продемонстрированы комплексы поведенческих методов, наиболее доказательно подтверждающих воспроизводимость полученных результатов при клинических испытаниях. Проведено описание и оценка поведенческих методов, характеризующих состояние тревожности, которые используются для скрининга новых соединений с анксиолитической активностью (тесты «Открытое поле», «Темно-светлая камера», «Приподнятый крестообразный лабиринт», «Последовательность лучей»). Широко представлен спектр тестов, применяемых для изучения когнитивных функций и процессов памяти (различные лабиринты – Т-образный, У-образный, радиальный лабиринт, лабиринт Барнс, Е-лабиринт; водные лабиринты – Морриса, Т-лабиринт) с описанием сравнительного анализа и необходимых условий, обеспечивающих достоверность информации. Важным направлением в области поведенческой фармакологии является моделирование нарушений социального поведения и исследование подходов для его коррекции – основные методы, необходимые для исследования социального поведения, представлены в обзоре тестами «Трехкамерный социальный тест», тест «Открытое поле» расширенный и др.
Заключение. Фармакология поведения диктует необходимость тесного взаимодействия доклинических и клинических этапов исследований в рамках развития трансляционной медицины и разработки подходов, доказательно подтверждающих воспроизводимость полученных результатов при клинических испытаниях. Необходимы также усовершенствование существующих и разработка новых поведенческих моделей психических расстройств, и поиск новых путей к изучению механизмов формирования нарушений поведения.
Введение. Для использования лекарственного препарата, который применяют при лечении одного заболевания, на профилактику и лечение другого патологического процесса существует метод перепрофилирования лекарственных средств (ЛС). Создание лекарств с нуля занимает долгое время разработки и внедрения, что ведет к крупным финансовым расходам, а также имеет высокий процент отсева веществ-кандидатов и требует значительных финансовых расходов. Основное преимущество перепрофилирования вместо создания новых ЛС – относительно низкие финансовые затраты и значительное сокращение первых двух фаз клинических исследований.
Текст. Перепрофилирование ЛС базируется на фармакологии, фармакокинетике, фармакодинамике, фармацевтике и клиническим испытания, где первые две фазы существенно сокращаются в сравнении с созданием полностью нового ЛС. Имеются примеры успешного перепрофилирования и негативных побочных эффектов при off-label применении лекарств, что является небезопасным, но лучшим решением при орфанных заболеваниях. Проводится направленный поиск возможностей перепрофилирования ЛС с применением автоматической процедуры, где проверяется большое количество химических соединений на активность или аффинность по отношению к рецепторам и ферментам – высокопроизводительного скринига. Широкое распространение получил компьютерный дизайн, который или перепрофилирование «in silico», где используется информация о препарате: мишени, химические структуры, метаболические пути, побочные эффекты, с последующим построением соответствующих моделей. Алгоритмы машинного обучения (МО): байесовский классификатор, логистическая регрессия, дерево решений, машина опорных векторов, случайный лес и другие успешно используются в биохимических фармацевтических, токсикологических исследованиях. Но наиболее перспективное развитие перепрофилирования связывают с использованием глубинных нейронных сетей (ГНС). С применением глубинного обучения было обнаружено, что ГНС превзошли прочие алгоритмы для разработки препаратов и предсказания их токсичности.
Заключение. В настоящее время интерес к перепрофилированию лекарственных препаратов заметно вырос. Поиск, по ключевым словам, «drug repurposing» выдал 2422 статьи, посвященных проблеме нового применения уже применяемых в медицине лекарств.
Introduction. As the first approved drug for amyotrophic lateral sclerosis (ALS) treatment, riluzole is known as a glutamatergic neurotransmission inhibitor administrated in 50 mg tablets twice daily. For this reason, a generic product of riluzole has been developed at a lower price by Hogar-Daroo, Iran, which would benefit patients.
Aim. The objective of this study is to develop and validate a novel liquid chromatography-tandem mass spectrometry (LC-MS/MS) method for the analysis of riluzole in human plasma samples and its application in the bioequivalence study of riluzole tablet.
Materials and methods. The chromatography was performed by using a C18 column (100 mm, 4.6 mm, 5 mm), 0.1 % formic acid and acetonitrile (60 : 40, v/v) as the mobile phase, at a flow rate of 0.90 ml/min in the gradient program. Carbamazepine was used as an internal standard (IS). The method employed only 100 µL of human plasma for quantification by a liquid-liquid extraction technique. The multiple reaction monitoring modes (MRM) was used for quantification of ion transitions m/z 235.0/165.9 and m/z 137.6/110.0 for riluzole and the m/z 236.9/194.0 for the IS. Dwell time was set at 200 ms.
Results and discussion. The calibration curve was linear over the concentration range 0.5–300 ng/mL. The lower limit of quantitation (LLOQ) was obtained at 0.5 ng/mL. The intra-day and inter-day accuracy ranged from 93.21 % to 101.34 % and 91.77 % to 104.88 % respectively. The intra-day and inter-day precision values ranged from 2.19 % to 5.69 % and 1.67 % to 5.31 % respectively, all within the FDA acceptable ±15 %.
Conclusion. The validated method was applied in Iranian healthy subjects under fasting condition with a 50 mg riluzole tablet successfully.
Введение. Род Astragalus L. – астрагал – один из крупнейших родов цветковых растений и насчитывает в своем составе не менее 3270 видов. Отдельные виды этого рода давно используются в традиционной и научной медицине. В последние годы виды рода Astragalus L. привлекают внимание из-за выявления у его представителей широкого спектра нейробиологических эффектов. В обзоре представлен анализ литературных данных об экспериментальных и отчасти клинических исследованиях разнообразных нейробиологических эффектов экстрактов и химических соединений видов данного рода и перспективах их применения в медицине.
Текст. Установлено разнообразное нейропротективное действие данных соединений. Отмечено, что во многих случаях в качестве механизма нейропротекции выступает ингибирование окислительного стресса, который играет важную роль в развитии ряда нейродегенеративных заболеваний. Химические соединения, содержащиеся в представителях данного рода, защищают нейроны головного мозга от ишемического повреждения, воздействия нейротоксинов и глутамата, отложения бета-амилоида. Было выявлено, что данные вещества ингибируют повышенную активность ацетилхолинэстеразы и процессы димиелинизации. Данные соединения также улучшают когнитивные функции, включая память и обучение. Установлено их противосудорожное действие. Особый интерес представляют данные, свидетельствующие о возможности применения некоторых химических соединений, содержащихся в представителях рода Astragalus L., в терапии психических заболеваний, в частности шизофрении.
Заключение. Анализ экспериментальных работ за последние десять лет показывает, что экстракты и химические соединения видов рода Astragalus L. обладают весьма разнородным спектром нейробиологического действия и, вероятно, могут найти применение в будущем в качестве средств терапии в неврологической и психиатрической практике. К сожалению, в отличие от большого числа доклинических экспериментов, клинические испытания этих соединений являются единичными. Обращает на себя внимание также, что к настоящему времени в отношении нейробиологической активности исследовано менее одного процента видов этого рода. Таким образом, необходимы более обширные исследования, клинические испытания, исследования по стандартизации и установлению терапевтических доз для человека экстрактов и химических соединений видов рода Astragalus L.
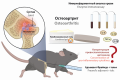
Введение. В настоящее время остеоартрит считается медленно протекающим воспалительным заболеванием, полностью поражающим сустав. Немаловажную роль в развитии данной патологии играет воспаление синовиальной оболочки и связок (синовит), дополненное постоянными механическими нагрузками. В норме в хряще наблюдается баланс противовоспалительных и провоспалительных медиаторов, однако при воздействии факторов риска это равновесие сдвигается в сторону последних.
Цель. Оценка влияния ранее разработанной мягкой лекарственной формы, содержащей мелоксикам, производное пурина и иммуномодулятор М на уровень провоспалительных цитокинов: ИЛ-1α, ИЛ-1β, ИЛ-6 и ФНО-α при остеоартрите.
Материалы и методы. В эксперимент было включено 25 животных, которых методом простой рандомизации разделили на 5 групп: 1 – испытуемая (гель 0,5 %), 2 – испытуемая (гель 1 %), 3 – референтная (Амелотекс®, гель 1 %), 4 – контроль (гелевая основа); 5 – интакт. Доклиническое моделирование патологии было проведено путем сочетанного введения в полость скакательного (заплюсневого) сустава крыс самцов линии Brown Norvay Catholic Rats по 0,1 мл смеси полного адъюванта Фрейнда с 10 % суспензией талька в изотоническом растворе натрия хлорида в соотношении 1 : 10. Иммуноферментный анализ сыворотки крови животных на 28 день эксперимента проводили с помощью стандартных планшетных наборов ELISA (Cloud-Clone Corp., США). Статистическую обработку данных проводили с использованием программного обеспечения GraphPad Prism 8.0.2 (GraphPad Software Inc., США), различия считали статистически значимыми при р < 0,05.
Результаты и обсуждение. Разработанные составы способствовали снижению уровня провоспалительных цитокинов (ИЛ-1α, ИЛ-6 и ФНО-α) по сравнению с гелевой основной и референтным препаратом. При этом выявлены различия между эффектом, наблюдаемым от применения испытуемых средств (геля 0,5 %, геля 1 %) и референтного препарата по влиянию на уровень ИЛ-1α и ФНО-α, что свидетельствует о большей эффективности подобранной комбинации действующих веществ, ведь, в отличие от однокомпонентного геля Амелотекс®, разработанные нами составы дополнительно включали производное пурина и иммуномодулятор М. Полученные данные важны с точки зрения понимания механизма действия мягкой лекарственной формы.
Заключение. По результатам предыдущих и настоящих исследований предполагается, что наибольший интерес для клинической практики представляет комбинированный состав мягкой лекарственной формы с половинной (0,5 %) концентрацией мелоксикама, поскольку его применение при высоком уровне эффективности дополнительно позволяет снизить вероятность возникновения нежелательных реакций со стороны нестероидного противовоспалительного средства, что важно в случае длительной терапии остеоартрита.
Введение. Новая коронавирусная инфекция [Coronavirus Disease 2019 (COVID-19)] – острое инфекционное заболевание, вызываемое вирусом SARS-CoV-2 (Severe acute respiratory syndrome-related coronavirus 2), которое продолжает представлять серьезную опасность для здоровья. Молнупиравир и фавипиравир – противовирусные препараты с анти-РНК-полимеразной активностью, одобренные Министерством здравоохранения Российской Федерации для лечения COVID-19. Разработка и валидация методики совместного определения метаболита молнупиравира β-D-N4-гидроксицитидина и фавипиравира в плазме крови человека является необходимой процедурой для проведения аналитической части клинического исследования с целью дальнейшего изучения фармакокинетики.
Цель. Целью исследования является разработка и валидация методики совместного определения β-D-N4-гидроксицитидина и фавипиравира в плазме крови человека методом высокоэффективной жидкостной хроматографии с тандемным масс-селективным детектированием (ВЭЖХ-МС/МС) для дальнейшего изучения фармакокинетики молнупиравира и фавипиравира.
Материалы и методы. Определение β-D-N4-гидроксицитидина и фавипиравира в плазме крови человека проводили методом ВЭЖХ-МС/МС. В качестве пробоподготовки был использован способ осаждения белков 0,1 % раствором муравьиной кислоты в ацетонитриле. Внутренний стандарт: прометазин. Подвижная фаза: аммонийно-формиатный буфер 0,01 моль/л (Элюент А), 0,1 % муравьиной кислоты, 10 % воды в ацетонитриле с прибавлением 0,08 % аммиака (Элюент В). Колонка: Shim-pack GWS C18, 150 × 4,6 мм, 5 мкм. Аналитический диапазон методики: 50,00–10000,00 нг/мл для β-D-N4-гидроксицитидина, 250,00–20000,00 нг/мл для фавипиравира в плазме крови. Источник ионизации: электроспрей. Условия детектирования: 260,00 m/z → 82,10 m/z, 260,00 m/z → 111,00 m/z, 260,00 m/z → 127,95 m/z (β-D-N4-гидроксицитидин); 156,15 m/z → 65,95 m/z, 156,15 m/z → 85,00 m/z, 156,15 m/z → 113,10 m/z (фавипиравир); 285,05 m/z → 198,05 m/z (прометазин).
Результаты и обсуждение. Разработанная методика была валидирована по следующим параметрам: селективность, пригодность стандартного образца, эффект матрицы, калибровочная кривая, точность, прецизионность, степень извлечения, нижний предел количественного определения перенос пробы, стабильность.
Заключение. Разработана и валидирована методика совместного определения β-D-N4-гидроксицитидина и фавипиравира в плазме крови человека методом ВЭЖХ-МС/МС. Подтвержденный аналитический диапазон методики составил 50,00–10000,00 нг/мл для β-D-N4-гидроксицитидина и 250,00–20000,00 нг/мл для фавипиравира в плазме крови. Полученный аналитический диапазон позволяет применять разработанную методику для проведения фармакокинетических исследований комбинированных препаратов молнупиравира и фавипиравира.
РЕГУЛЯТОРНЫЕ ВОПРОСЫ
Введение. Результаты вне спецификации (OOS results) представляют собой серьезную проблему при разработке, валидации и использовании методик «Количественное определение» и «Растворение». Тема актуальная, что подтверждается данными поиска в Internet по фразе «Out-of-Specification» + «HPLC» – найдено около 35 300 результатов.
Текст. Рассмотрены и систематизированы в виде сводной таблицы важные для практики аналитические и технологические причины (факторы), которые могут приводить к получению заниженных или завышенных результатов анализов. Речь идет о следующих факторах. Факторы, связанные с расчетной формулой. Факторы, связанные с подготовкой проб (образцов). Факторы, связанные с растворителем образца и соотношением pH раствора образца и подвижной фазы. Факторы, связанные с хроматограммами и их обработкой. Основные технологические факторы.
Заключение. Представлены данные и рекомендации для поиска аналитических и технологических причин получения результатов Out-of-Specification в случае тестов «Количественное определение» и «Растворение».
ISSN 2658-5049 (Online)